Propecia 1mg, 5mg Finasteride Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Propecia 1 mg en hoe wordt het gebruikt?
Propecia is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van goedaardige prostaathyperplasie (BPH), haarverlies bij mannen (alopecia androgenetica). Propecia kan alleen of in combinatie met andere medicijnen worden gebruikt.
Propecia 1 mg behoort tot een klasse geneesmiddelen die 5-alfa-reductaseremmers worden genoemd.
Het is niet bekend of Propecia 1 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Propecia 5 mg?
Propecia 1 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- borst knobbels,
- borstpijn of gevoeligheid,
- tepelontlading, en
- andere borstveranderingen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Propecia 5 mg zijn:
- verlies van interesse in seks,
- impotentie,
- moeite hebben om een orgasme te krijgen, en
- abnormale ejaculatie
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Propecia. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
PROPECIA (finasteride) tabletten bevatten finasteride als het werkzame bestanddeel. Finasteride, een synthetische 4-azasteroïde verbinding, is een specifieke remmer van steroïde Type II 5α-reductase, een intracellulair enzym dat het androgeentestosteron omzet in 5α-dihydrotestosteron (DHT).
De chemische naam van finasteride is N-tert-Butyl-3-oxo-4-aza-5α-androst-1-een-17β-carboxamide. De empirische formule van finasteride is C23H36N2O2 en het molecuulgewicht is 372,55. De structuurformule is:
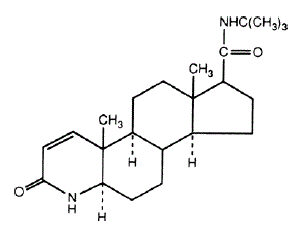
Finasteride is een wit kristallijn poeder met een smeltpunt in de buurt van 250°C. Het is vrij oplosbaar in chloroform en in oplosmiddelen met een lager alcoholgehalte, maar is praktisch onoplosbaar in water.
PROPECIA (finasteride) tabletten zijn filmomhulde tabletten voor orale toediening. Elke tablet bevat 1 mg finasteride en de volgende inactieve ingrediënten: lactosemonohydraat, microkristallijne cellulose, gepregelatiniseerd zetmeel, natriumzetmeelglycolaat, hydroxypropylmethylcellulose, hydroxypropylcellulose, titaniumdioxide, magnesiumstearaat, talk, docusaatnatrium, geel ijzeroxide en rood ijzeroxide oxyde.
INDICATIES
PROPECIA® is geïndiceerd voor de behandeling van haarverlies bij mannen (alopecia androgenetica) UITSLUITEND bij MANNEN.
De werkzaamheid bij bitemporale recessie is niet vastgesteld.
PROPECIA is niet geïndiceerd voor gebruik bij vrouwen.
DOSERING EN ADMINISTRATIE
PROPECIA kan met of zonder maaltijden worden toegediend.
De aanbevolen dosis PROPECIA is één tablet (1 mg) eenmaal daags.
Over het algemeen is dagelijks gebruik gedurende drie maanden of langer noodzakelijk voordat het voordeel wordt waargenomen. Voortgezet gebruik wordt aanbevolen om het voordeel te behouden, dat periodiek opnieuw moet worden geëvalueerd. Stopzetting van de behandeling leidt tot omkering van het effect binnen 12 maanden.
HOE GELEVERD
Doseringsvormen en sterke punten
PROPECIA 5 mg tabletten (1 mg) zijn geelbruine, achthoekige, filmomhulde convexe tabletten met het “gestileerde P”-logo aan de ene kant en PROPECIA 5 mg aan de andere kant.
PROPECIA tabletten, 1 mg, zijn lichtbruine, achthoekige, filmomhulde convexe tabletten met het “gestileerde P”-logo aan de ene kant en PROPECIA aan de andere kant. Ze worden als volgt geleverd:
NDC 78206-152-01 flesjes van 30 (met droogmiddel) NDC 78206-152-02 PROPAK-flessen van 90 ® (met droogmiddel).
Opslag en behandeling
Bewaren bij kamertemperatuur, 15-30 ° C (59-86 ° F). Houd de container gesloten en bescherm tegen vocht.
Vrouwen mogen geen geplette of gebroken PROPECIA-tabletten hanteren als ze zwanger zijn of mogelijk zwanger kunnen zijn vanwege de mogelijkheid van absorptie van finasteride en het daaruit voortvloeiende potentiële risico voor een mannelijke foetus. PROPECIA 5 mg tabletten zijn omhuld en voorkomen contact met het werkzame bestanddeel tijdens normaal gebruik, op voorwaarde dat de tabletten niet worden gebroken of fijngemaakt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties en Informatie over patiëntbegeleiding ].
Afst. door: Organon LLC, een dochteronderneming van ORGANON & Co., Jersey City, NJ 07302, VS. Herzien: juni 2021
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
Klinische onderzoeken naar PROPECIA (finasteride 1 mg) bij de behandeling van haarverlies bij mannen
In drie gecontroleerde klinische onderzoeken naar PROPECIA 5 mg met een duur van 12 maanden, werd 1,4% van de patiënten die PROPECIA gebruikten (n=945) stopgezet vanwege bijwerkingen die mogelijk, waarschijnlijk of zeker geneesmiddelgerelateerd werden geacht (1,6% voor placebo; n=934).
Klinische bijwerkingen die werden gemeld als mogelijk, waarschijnlijk of zeker geneesmiddelgerelateerd bij ≥1% van de patiënten die met PROPECIA of placebo werden behandeld, worden weergegeven in Tabel 1.
TABEL 1: Geneesmiddelgerelateerde bijwerkingen voor PROPECIA (finasteride 1 mg) in jaar 1 (%) HAARVERLIES VAN HET HAARVERLIES VAN HET MANNELIJKE PATROON
Geïntegreerde analyse van klinische bijwerkingen toonde aan dat tijdens de behandeling met PROPECIA 1 mg 36 (3,8%) van de 945 mannen een of meer van deze bijwerkingen hadden gemeld in vergelijking met 20 (2,1%) van de 934 mannen die werden behandeld met placebo (p=0,04) . Het herstel trad op bij mannen die vanwege deze bijwerkingen stopten met de behandeling met PROPECIA en bij de meeste van degenen die de behandeling voortzetten. De incidentie van elk van de bovengenoemde bijwerkingen daalde tot ≤0,3% tegen het vijfde jaar van behandeling met PROPECIA.
In een onderzoek met finasteride 1 mg per dag bij gezonde mannen werd een mediane afname van het ejaculaatvolume van 0,3 ml (-11%) vergeleken met 0,2 ml (-8%) voor placebo waargenomen na 48 weken behandeling. Twee andere onderzoeken toonden aan dat finasteride bij 5 maal de dosering van PROPECIA (5 mg per dag) een significante mediane afname van ongeveer 0,5 ml (-25%) veroorzaakte in vergelijking met placebo in het ejaculaatvolume, maar dit was reversibel na stopzetting van de behandeling.
In de klinische onderzoeken met PROPECIA waren de incidenties van gevoelige en vergroting van de borsten, overgevoeligheidsreacties en testiculaire pijn bij met finasteride behandelde patiënten niet verschillend van die bij patiënten die met placebo werden behandeld.
Gecontroleerde klinische onderzoeken en open langetermijnstudies voor PROSCAR® (finasteride 5 mg) en AVODART (dutasteride) bij de behandeling van goedaardige prostaathyperplasie
In de PROSCAR Long-Term Efficacy and Safety Study (PLESS), een 4 jaar durende gecontroleerde klinische studie, werden 3040 patiënten tussen de 45 en 78 jaar met symptomatische BPH en een vergrote prostaat beoordeeld op veiligheid gedurende een periode van 4 jaar (1524 op PROSCAR 5 mg/dag en 1516 op placebo). 3,7% (57 patiënten) behandeld met PROSCAR 5 mg en 2,1% (32 patiënten) behandeld met placebo stopten met de behandeling als gevolg van bijwerkingen gerelateerd aan seksuele functie, de meest gemelde bijwerkingen.
Tabel 2 geeft de enige klinische bijwerkingen weer die door de onderzoeker mogelijk, waarschijnlijk of zeker geneesmiddelgerelateerd werden geacht, waarbij de incidentie op PROSCAR ≥1% en hoger was dan placebo gedurende de 4 jaar van het onderzoek. In jaar 2-4 van de studie was er geen significant verschil tussen de behandelingsgroepen in de incidentie van impotentie, verminderd libido en ejaculatiestoornis.
TABEL 2: Geneesmiddelgerelateerde bijwerkingen voor PROSCAR (finasteride 5 mg) goedaardige PROSTATISCHE HYPERPLASIE
De bijwerkingenprofielen in de 1-jarige, placebogecontroleerde, fase III BPH-onderzoeken en de 5-jarige open verlengingen met PROSCAR 5 mg en PLESS waren vergelijkbaar.
Er zijn geen aanwijzingen voor toegenomen seksuele bijwerkingen bij een langere behandelingsduur met PROSCAR 5 mg. Nieuwe meldingen van drugsgerelateerde seksuele bijwerkingen namen af met de duur van de therapie.
Tijdens het 4 tot 6 jaar durende placebo- en comparator-gecontroleerde onderzoek naar medische therapie van prostaatsymptomen (MTOPS) waaraan 3047 mannen deelnamen, waren er 4 gevallen van borstkanker bij mannen die met PROSCAR werden behandeld, maar geen gevallen bij mannen die niet met PROSCAR werden behandeld. Tijdens de 4-jarige placebogecontroleerde PLESS-studie waaraan 3040 mannen deelnamen, waren er 2 gevallen van borstkanker bij met placebo behandelde mannen, maar er werden geen gevallen gemeld bij mannen die met PROSCAR werden behandeld.
Tijdens de 7-jarige placebogecontroleerde Prostate Cancer Prevention Trial (PCPT) waaraan 18.882 mannen deelnamen, was er 1 geval van borstkanker bij mannen die werden behandeld met PROSCAR en 1 geval van borstkanker bij mannen die werden behandeld met placebo. De relatie tussen langdurig gebruik van finasteride en mannelijke borstneoplasie is momenteel niet bekend.
De PCPT-studie was een 7-jarige gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie waaraan 18.882 gezonde mannen ≥55 jaar deelnamen met een normaal digitaal rectaal onderzoek en een PSA ≤3,0 ng/ml. Mannen kregen dagelijks PROSCAR (finasteride 5 mg) of placebo. Patiënten werden jaarlijks geëvalueerd met PSA en digitale rectale onderzoeken. Biopsieën werden uitgevoerd voor verhoogde PSA, een abnormaal digitaal rectaal onderzoek of het einde van de studie. De incidentie van Gleason-score 8-10 prostaatkanker was hoger bij mannen die werden behandeld met finasteride (1,8%) dan bij mannen die werden behandeld met placebo (1,1%). In een 4 jaar durende placebogecontroleerde klinische studie met een andere 5α-reductaseremmer [AVODART (dutasteride)] werden vergelijkbare resultaten voor Gleason-score 8-10 prostaatkanker waargenomen (1% dutasteride versus 0,5% placebo). De klinische betekenis van deze bevindingen met betrekking tot het gebruik van PROPECIA door mannen is niet bekend.
Er is geen klinisch voordeel aangetoond bij patiënten met prostaatkanker die worden behandeld met PROSCAR. PROSCAR is niet goedgekeurd om het risico op het ontwikkelen van prostaatkanker te verminderen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van PROPECIA na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting te maken van hun frequentie of een oorzakelijk verband te leggen met blootstelling aan geneesmiddelen:
Overgevoeligheidsreactie: overgevoeligheidsreacties zoals huiduitslag, pruritus, urticaria en angio-oedeem (inclusief zwelling van de lippen, tong, keel en gezicht);
Voortplantingssysteem: seksuele disfunctie die aanhield na stopzetting van de behandeling, waaronder erectiestoornissen, libidostoornissen, ejaculatiestoornissen en orgasmestoornissen; mannelijke onvruchtbaarheid en/of slechte zaadkwaliteit (normalisatie of verbetering van zaadkwaliteit is gemeld na stopzetting van finasteride); testiculaire pijn; hematospermie.
Neoplasmata: mannelijke borstkanker;
Borstaandoeningen: gevoelige borsten en vergroting;
Zenuwstelsel/psychiatrisch: depressie
DRUG-INTERACTIES
Cytochroom P450-gekoppeld geneesmiddelmetaboliserend enzymsysteem
Er zijn geen geneesmiddelinteracties van klinisch belang vastgesteld. Finasteride lijkt het cytochroom P450-gekoppelde geneesmiddelmetaboliserende enzymsysteem niet te beïnvloeden. Verbindingen die bij de mens zijn getest, omvatten antipyrine, digoxine, propranolol, theofylline en warfarine en er werden geen klinisch betekenisvolle interacties gevonden.
Andere gelijktijdige therapie
Hoewel er geen specifieke interactiestudies werden uitgevoerd, werden finasteridedoses van 1 mg of meer gelijktijdig gebruikt in klinische studies met paracetamol, acetylsalicylzuur, bètablokkers, analgetica, angiotensine-converting enzyme (ACE)-remmers, anticonvulsiva, benzodiazepinen, bètablokkers, calcium -kanaalblokkers, cardiale nitraten, diuretica, H2-antagonisten, HMG-CoA-reductaseremmers, prostaglandinesynthetaseremmers (ook wel NSAID's genoemd) en chinolon-anti-infectiemiddelen zonder bewijs van klinisch significante nadelige interacties.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Blootstelling van vrouwen - risico voor mannelijke foetus
PROPECIA is niet geïndiceerd voor gebruik bij vrouwen. Vrouwen mogen geen geplette of gebroken PROPECIA-tabletten hanteren als ze zwanger zijn of mogelijk zwanger kunnen zijn vanwege de mogelijkheid van absorptie van finasteride en het daaruit voortvloeiende potentiële risico voor een mannelijke foetus. PROPECIA-tabletten zijn omhuld en voorkomen contact met het werkzame bestanddeel tijdens normaal gebruik, op voorwaarde dat de tabletten niet zijn gebroken of fijngemaakt. [Zien AANWIJZINGEN EN GEBRUIK , CONTRA-INDICATIES , Gebruik bij specifieke populaties , HOE GELEVERD / Opslag en behandeling en Informatie over patiëntbegeleiding ]
Effecten op prostaatspecifiek antigeen (PSA)
In klinische onderzoeken met PROPECIA (finasteride, 1 mg) bij mannen van 18-41 jaar daalde de gemiddelde waarde van het serum prostaatspecifiek antigeen (PSA) van 0,7 ng/ml bij baseline tot 0,5 ng/ml in maand 12. Verder, in klinische onderzoeken met PROSCAR (finasteride, 5 mg) bij gebruik bij oudere mannen met goedaardige prostaathyperplasie (BPH), zijn de PSA-spiegels met ongeveer 50% verlaagd. Andere onderzoeken met PROSCAR toonden aan dat het ook verlagingen van de serum-PSA kan veroorzaken in de aanwezigheid van prostaatkanker. Met deze bevindingen moet rekening worden gehouden voor een juiste interpretatie van serum-PSA bij het evalueren van mannen die met finasteride worden behandeld. Elke bevestigde stijging van de laagste PSA-waarde tijdens het gebruik van PROPECIA kan wijzen op de aanwezigheid van prostaatkanker en moet worden geëvalueerd, zelfs als de PSA-waarden nog steeds binnen het normale bereik liggen voor mannen die geen 5α-reductaseremmer gebruiken. Niet-naleving van de therapie met PROPECIA 5 mg kan ook de PSA-testresultaten beïnvloeden.
Verhoogd risico op hoogwaardige prostaatkanker met 5α-reductaseremmers
Mannen van 55 jaar en ouder met een normaal digitaal rectaal onderzoek en een PSA ≤3,0 ng/ml bij baseline die finasteride 5 mg/dag (5 maal de dosis PROPECIA) innamen in de 7-jarige Prostate Cancer Prevention Trial (PCPT) hadden een verhoogd risico van Gleason score 8-10 prostaatkanker (finasteride 1,8% vs placebo 1,1%). [Zien ONGEWENSTE REACTIES ] Vergelijkbare resultaten werden waargenomen in een 4 jaar durende placebogecontroleerde klinische studie met een andere 5α-reductaseremmer (dutasteride, AVODART) (1% dutasteride versus 0,5% placebo). 5α-reductaseremmers kunnen het risico op het ontwikkelen van hooggradige prostaatkanker verhogen. Of het effect van 5α-reductaseremmers op het verminderen van het prostaatvolume of studiegerelateerde factoren de resultaten van deze onderzoeken beïnvloedden, is niet vastgesteld.
Pediatrische patiënten
PROPECIA is niet geïndiceerd voor gebruik bij pediatrische patiënten [zie: Gebruik bij specifieke populaties ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Blootstelling van vrouwen - risico voor mannelijke foetus
Artsen dienen patiënten te informeren dat vrouwen die zwanger zijn of mogelijk zwanger kunnen zijn, geen fijngemaakte of gebroken PROPECIA-tabletten mogen hanteren vanwege de mogelijkheid van absorptie van finasteride en het daaruit voortvloeiende potentiële risico voor een mannelijke foetus. PROPECIA 5 mg tabletten zijn omhuld en voorkomen contact met het werkzame bestanddeel tijdens normaal gebruik, op voorwaarde dat de tabletten niet gebroken of fijngemaakt zijn. Als een vrouw die zwanger is of mogelijk zwanger is in contact komt met fijngemaakte of gebroken PROPECIA 1 mg tabletten, moet het contactgebied onmiddellijk worden gewassen met water en zeep [zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties en HOE GELEVERD / Opslag en behandeling ].
Verhoogd risico op hoogwaardige prostaatkanker
Patiënten moeten worden geïnformeerd dat er een toename was van hooggradige prostaatkanker bij mannen die werden behandeld met 5α-reductaseremmers die waren geïndiceerd voor BPH-behandeling, vergeleken met degenen die werden behandeld met placebo in onderzoeken naar het gebruik van deze geneesmiddelen om prostaatkanker te voorkomen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
Aanvullende instructies
Artsen dienen hun patiënten te instrueren om eventuele veranderingen in hun borsten, zoals knobbels, pijn of tepelafscheiding, onmiddellijk te melden. Borstveranderingen waaronder borstvergroting, gevoeligheid en neoplasma zijn gemeld [zie: ONGEWENSTE REACTIES ].
Artsen dienen hun patiënten te instrueren om de bijsluiter van de patiënt te lezen voordat de behandeling met PROPECIA wordt gestart en deze elke keer dat het voorschrift wordt vernieuwd, opnieuw te lezen, zodat zij op de hoogte zijn van de actuele informatie voor patiënten met betrekking tot PROPECIA.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er werd geen bewijs van een tumorverwekkend effect waargenomen in een studie van 24 maanden bij Sprague-Dawley-ratten die doses finasteride kregen tot 160 mg/kg/dag bij mannetjes en 320 mg/kg/dag bij vrouwtjes. Deze doses veroorzaakten respectievelijk systemische blootstelling bij ratten van 888 en 2192 maal die waargenomen bij de mens die de aanbevolen dosis voor de mens van 1 mg/dag kregen. Alle blootstellingsberekeningen waren gebaseerd op de berekende AUC (0-24 uur) voor dieren en de gemiddelde AUC (0-24 uur) voor de mens (0,05 g•uur/ml).
In een carcinogeniteitsonderzoek van 19 maanden bij CD-1-muizen werd een statistisch significante (p≤0,05) toename in de incidentie van testiculaire Leydig-celadenomen waargenomen bij 1824 maal de menselijke blootstelling (250 mg/kg/dag). Bij muizen bij 184 maal de menselijke blootstelling, geschat (25 mg/kg/dag) en bij ratten bij 312 maal de menselijke blootstelling (≥40 mg/kg/dag) werd een toename in de incidentie van Leydig-celhyperplasie waargenomen. Een positieve correlatie tussen de proliferatieve veranderingen in de Leydig-cellen en een verhoging van de serum-LH-spiegels (2- tot 3-voudig boven de controle) is aangetoond bij beide knaagdiersoorten die werden behandeld met hoge doses finasteride. Er werden geen geneesmiddelgerelateerde Leydig-celveranderingen waargenomen bij ratten of honden die gedurende 1 jaar werden behandeld met finasteride 240 en 2800 keer (respectievelijk 20 mg/kg/dag en 45 mg/kg/dag), of bij muizen die gedurende 19 maanden werden behandeld. bij 18,4 maal de menselijke blootstelling, geschat (2,5 mg/kg/dag).
Er werd geen bewijs van mutageniteit waargenomen in een in vitro bacteriële mutagenesetest, een zoogdiercelmutagenesetest of in een in vitro alkalische elutietest. In een in vitro chromosoomafwijkingstest, waarbij gebruik werd gemaakt van ovariumcellen van Chinese hamsters, was er een lichte toename van chromosoomafwijkingen. In een in vivo chromosoomafwijkingstest bij muizen werd geen behandelingsgerelateerde toename van chromosoomafwijkingen waargenomen met finasteride bij de maximaal getolereerde dosis van 250 mg/kg/dag (1824 keer de blootstelling bij de mens), zoals bepaald in de carcinogeniteitsstudies.
Bij geslachtsrijpe mannelijke konijnen die werden behandeld met finasteride bij een blootstelling van 4344 maal de menselijke blootstelling (80 mg/kg/dag) gedurende maximaal 12 weken, werd geen effect op de vruchtbaarheid, het aantal zaadcellen of het ejaculaatvolume waargenomen. Bij geslachtsrijpe mannelijke ratten die werden behandeld met 488 keer de menselijke blootstelling (80 mg/kg/dag), waren er geen significante effecten op de vruchtbaarheid na 6 of 12 weken behandeling; wanneer de behandeling echter tot 24 of 30 weken werd voortgezet, was er een duidelijke afname van de vruchtbaarheid, vruchtbaarheid en een bijbehorende significante afname van het gewicht van de zaadblaasjes en de prostaat. Al deze effecten waren omkeerbaar binnen 6 weken na stopzetting van de behandeling. Er is geen geneesmiddelgerelateerd effect op de testikels of op de paringsprestaties waargenomen bij ratten of konijnen. Deze afname van de vruchtbaarheid bij met finasteride behandelde ratten is secundair aan het effect op de bijkomende geslachtsorganen (prostaat en zaadblaasjes), wat resulteert in het niet vormen van een zaadprop. De zaadprop is essentieel voor een normale vruchtbaarheid bij ratten, maar is niet relevant voor de mens.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie X [zie CONTRA-INDICATIES ]. PROPECIA 5 mg is gecontra-indiceerd voor gebruik bij vrouwen die zwanger zijn of kunnen worden. PROPECIA 5 mg is een Type II 5α-reductaseremmer die de omzetting van testosteron in 5α-dihydrotestosteron (DHT), een hormoon dat nodig is voor de normale ontwikkeling van mannelijke genitaliën, voorkomt. In dierstudies veroorzaakte finasteride een abnormale ontwikkeling van uitwendige genitaliën bij mannelijke foetussen. Als dit geneesmiddel tijdens de zwangerschap wordt gebruikt, of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënt op de hoogte worden gesteld van het mogelijke gevaar voor de mannelijke foetus.
Abnormale mannelijke genitale ontwikkeling is een verwacht gevolg wanneer de omzetting van testosteron in 5α-dihydrotestosteron (DHT) wordt geremd door 5α-reductaseremmers. Deze uitkomsten zijn vergelijkbaar met die gerapporteerd bij mannelijke zuigelingen met genetische 5α-reductasedeficiëntie. Vrouwen kunnen worden blootgesteld aan finasteride door contact met fijngemaakte of gebroken PROPECIA 5 mg tabletten of sperma van een mannelijke partner die PROPECIA gebruikt. Met betrekking tot blootstelling aan finasteride via de huid, zijn PROPECIA-tabletten omhuld en voorkomen ze huidcontact met finasteride tijdens normaal gebruik als de tabletten niet zijn fijngemaakt of gebroken. Vrouwen die zwanger zijn of zwanger kunnen worden, mogen geen fijngemaakte of gebroken PROPECIA 5 mg tabletten hanteren vanwege de mogelijke blootstelling van een mannelijke foetus. Als een zwangere vrouw in contact komt met fijngemaakte of gebroken PROPECIA 1 mg tabletten, moet het contactgebied onmiddellijk worden gewassen met water en zeep. Met betrekking tot mogelijke blootstelling aan finasteride via sperma, is een onderzoek uitgevoerd bij mannen die PROPECIA 1 mg/dag kregen, waarbij de finasterideconcentraties in sperma werden gemeten [zie KLINISCHE FARMACOLOGIE ].
In een embryo-foetale ontwikkelingsstudie kregen zwangere ratten finasteride tijdens de periode van belangrijke organogenese (draagtijd 6 tot 17). Bij maternale doses oraal finasteride van ongeveer 1 tot 684 maal de aanbevolen dosis voor de mens (RHD) van 1 mg/dag (gebaseerd op de AUC bij dierdoses van 0,1 tot 100 mg/kg/dag) was er een dosisafhankelijke toename van hypospadie die optrad in 3,6 tot 100% van de mannelijke nakomelingen. Blootstellingsveelvouden werden geschat met behulp van gegevens van niet-zwangere ratten. Dagen 16 tot 17 van de zwangerschap is een kritieke periode bij mannelijke foetale ratten voor differentiatie van de uitwendige genitaliën. Bij orale maternale doses van ongeveer 0,2 keer de RHD (gebaseerd op de AUC bij een dierdosis van 0,03 mg/kg/dag), hadden mannelijke nakomelingen een verlaagd prostaat- en zaadblaasjesgewicht, vertraagde preputiale scheiding en voorbijgaande tepelontwikkeling. Een verminderde anogenitale afstand trad op bij mannelijke nakomelingen van zwangere ratten die ongeveer 0,02 keer de RHD kregen (gebaseerd op de AUC bij een dierdosis van 0,003 mg/kg/dag). Er werden geen afwijkingen waargenomen bij vrouwelijke nakomelingen die in utero waren blootgesteld aan enige dosis finasteride.
Er werden geen ontwikkelingsafwijkingen waargenomen bij de nakomelingen van onbehandelde vrouwtjes die gepaard waren met met finasteride behandelde mannelijke ratten die ongeveer 488 keer de RHD kregen (gebaseerd op de AUC bij een dierdosis van 80 mg/kg/dag). Een licht verminderde vruchtbaarheid werd waargenomen bij mannelijke nakomelingen na toediening van ongeveer 20 maal de RHD (gebaseerd op de AUC bij een dierdosis van 3 mg/kg/dag) aan vrouwelijke ratten tijdens de late dracht en lactatie. Onder deze omstandigheden werden geen effecten op de vruchtbaarheid waargenomen bij vrouwelijke nakomelingen.
Er werden geen aanwijzingen gevonden voor mannelijke uitwendige genitale misvormingen of andere afwijkingen bij konijnenfoetussen die werden blootgesteld aan finasteride tijdens de periode van belangrijke organogenese (draagtijd 6-18) bij maternale doses tot 100 mg/kg/dag (blootstellingsniveaus aan finasteride werden niet gemeten in konijnen). Het is echter mogelijk dat deze studie niet de kritieke periode omvatte voor de effecten van finasteride op de ontwikkeling van mannelijke uitwendige genitaliën bij konijnen.
De foetale effecten van maternale blootstelling aan finasteride tijdens de periode van embryonale en foetale ontwikkeling werden geëvalueerd bij de resusaap (draagtijd 20-100), in een soort en ontwikkelingsperiode die meer voorspellend was voor specifieke effecten bij mensen dan de studies bij ratten en konijnen. Intraveneuze toediening van finasteride aan drachtige apen in doses van wel 800 ng/dag (geschatte maximale bloedconcentratie van 1,86 ng/ml of ongeveer 930 maal de hoogst geschatte blootstelling van zwangere vrouwen aan finasteride uit sperma van mannen die 1 mg/dag innamen) resulteerde in zonder afwijkingen bij mannelijke foetussen. Ter bevestiging van de relevantie van het rhesusmodel voor de ontwikkeling van de menselijke foetus, orale toediening van een dosis finasteride (2 mg/kg/dag of ongeveer 120.000 keer de hoogst geschatte bloedspiegels van finasteride uit sperma van mannen die 1 mg/dag innemen) aan zwangere apen resulteerden in uitwendige genitale afwijkingen bij mannelijke foetussen. Er werden geen andere afwijkingen waargenomen bij mannelijke foetussen en er werden bij geen enkele dosis finasteridegerelateerde afwijkingen waargenomen bij vrouwelijke foetussen.
Moeders die borstvoeding geven
PROPECIA is niet geïndiceerd voor gebruik bij vrouwen.
Het is niet bekend of finasteride wordt uitgescheiden in de moedermelk.
Pediatrisch gebruik
PROPECIA 1 mg is niet geïndiceerd voor gebruik bij pediatrische patiënten.
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Klinische werkzaamheidsonderzoeken met PROPECIA omvatten geen proefpersonen van 65 jaar en ouder. Op basis van de farmacokinetiek van finasteride 5 mg is bij ouderen voor PROPECIA geen dosisaanpassing nodig (zie KLINISCHE FARMACOLOGIE ]. De werkzaamheid van PROPECIA 1 mg bij ouderen is echter niet vastgesteld.
Leverfunctiestoornis
Voorzichtigheid is geboden bij de toediening van PROPECIA 5 mg bij patiënten met leverfunctiestoornissen, aangezien finasteride uitgebreid in de lever wordt gemetaboliseerd [zie KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Er is geen dosisaanpassing nodig bij patiënten met nierinsufficiëntie [zie: KLINISCHE FARMACOLOGIE ].
OVERDOSERING
In klinische onderzoeken leidden enkelvoudige doses finasteride tot 400 mg en meervoudige doses finasteride tot 80 mg/dag gedurende drie maanden niet tot bijwerkingen. Totdat er meer ervaring is opgedaan, kan geen specifieke behandeling voor een overdosis met finasteride worden aanbevolen.
Significante letaliteit werd waargenomen bij mannelijke en vrouwelijke muizen bij enkelvoudige orale doses van 1500 mg/m² (500 mg/kg) en bij vrouwelijke en mannelijke ratten bij enkelvoudige orale doses van 2360 mg/m² (400 mg/kg) en 5900 mg/m² (1000 mg/kg), respectievelijk.
CONTRA-INDICATIES
PROPECIA 5 mg is gecontra-indiceerd bij:
- Zwangerschap. Het gebruik van finasteride is gecontra-indiceerd bij vrouwen die zwanger zijn of mogelijk zwanger zijn. Vanwege het vermogen van type II 5α-reductaseremmers om de omzetting van testosteron in 5α-dihydrotestosteron (DHT) te remmen, kan finasteride afwijkingen veroorzaken aan de uitwendige genitaliën van een mannelijke foetus van een zwangere vrouw die finasteride krijgt. Als dit medicijn tijdens de zwangerschap wordt gebruikt of als er zwangerschap optreedt tijdens het gebruik van dit medicijn, moet de zwangere vrouw op de hoogte worden gesteld van het mogelijke gevaar voor de mannelijke foetus. [Zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties , HOE GELEVERD / Opslag en behandeling en Informatie over patiëntbegeleiding ] Bij vrouwelijke ratten hebben lage doses finasteride, toegediend tijdens de zwangerschap, bij mannelijke nakomelingen afwijkingen van de uitwendige genitaliën veroorzaakt.
- Overgevoeligheid voor een van de bestanddelen van dit medicijn.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Finasteride is een competitieve en specifieke remmer van Type II 5α-reductase, een intracellulair enzym dat het androgeentestosteron omzet in DHT. Twee verschillende isozymen worden gevonden bij muizen, ratten, apen en mensen: Type I en II. Elk van deze isozymen wordt differentieel tot expressie gebracht in weefsels en ontwikkelingsstadia. Bij mensen is type I 5α-reductase overheersend in de talgklieren van de meeste huidgebieden, waaronder de hoofdhuid en de lever. Type I 5α-reductase is verantwoordelijk voor ongeveer een derde van de circulerende DHT. Het type II 5α-reductase-isozym wordt voornamelijk aangetroffen in de prostaat, zaadblaasjes, epididymiden en haarzakjes, evenals in de lever, en is verantwoordelijk voor tweederde van de circulerende DHT.
Bij mensen is het werkingsmechanisme van finasteride gebaseerd op de preferentiële remming van het type II isozym. Met gebruikmaking van natuurlijke weefsels (hoofdhuid en prostaat) toonden in vitro bindingsonderzoeken naar het vermogen van finasteride om beide isozymen te remmen een 100-voudige selectiviteit voor het humane Type II 5α-reductase ten opzichte van Type I isozymen (IC50 = 500 en 4,2 nM voor Type I en II, respectievelijk). Voor beide isozymen gaat de remming door finasteride gepaard met reductie van de remmer tot dihydrofinasteride en adductvorming met NADP+. De omzetting voor het enzymcomplex is traag (t = ongeveer 30 dagen voor het Type II-enzymcomplex en 14 dagen voor het Type I-complex). Remming van Type II 5α-reductase blokkeert de perifere omzetting van testosteron in DHT, wat resulteert in significante verlagingen van de DHT-concentraties in serum en weefsel.
Bij mannen met mannelijke haaruitval (alopecia androgenetica) bevat de kalende hoofdhuid geminiaturiseerde haarzakjes en verhoogde hoeveelheden DHT in vergelijking met een harige hoofdhuid. Toediening van finasteride verlaagt bij deze mannen de hoofdhuid- en serum-DHT-concentraties. De relatieve bijdragen van deze verlagingen aan het behandelingseffect van finasteride zijn niet gedefinieerd. Door dit mechanisme lijkt finasteride een sleutelfactor in de ontwikkeling van alopecia androgenetica te onderbreken bij patiënten met een genetische aanleg.
farmacodynamiek
Finasteride veroorzaakt een snelle verlaging van de serum-DHT-concentratie en bereikt een onderdrukking van 65% binnen 24 uur na orale toediening met een tablet van 1 mg. De gemiddelde circulerende niveaus van testosteron en estradiol waren met ongeveer 15% gestegen in vergelijking met de uitgangswaarde, maar deze bleven binnen het fysiologische bereik.
Finasteride heeft geen affiniteit voor de androgeenreceptor en heeft geen androgene, antiandrogene, oestrogene, anti-oestrogene of progestationele effecten. In onderzoeken met finasteride werden geen klinisch betekenisvolle veranderingen in luteïniserend hormoon (LH), follikelstimulerend hormoon (FSH) of prolactine waargenomen. Bij gezonde vrijwilligers veranderde de behandeling met finasteride de respons van LH en FSH op het gonadotropine-releasing hormoon niet, wat erop wijst dat de hypothalamus-hypofyse-testiculaire as niet was aangetast.
Finasteride had geen effect op de circulerende niveaus van cortisol, schildklierstimulerend hormoon of thyroxine, en evenmin op het plasmalipidenprofiel (bijv. totaal cholesterol, lipoproteïnen met lage dichtheid, lipoproteïnen met hoge dichtheid en triglyceriden) of de botmineraaldichtheid.
Farmacokinetiek
Absorptie
In een onderzoek bij 15 gezonde jonge mannelijke proefpersonen was de gemiddelde biologische beschikbaarheid van finasteride 1-mg tabletten 65% (bereik 26-170%), gebaseerd op de verhouding van de oppervlakte onder de curve (AUC) ten opzichte van een intraveneuze (IV) referentie dosis. Bij steady-state na dosering van 1 mg/dag (n=12) was de maximale plasmaconcentratie van finasteride gemiddeld 9,2 ng/ml (bereik, 4,9-13,7 ng/ml) en werd deze 1 tot 2 uur na de dosis bereikt; AUC was 53 ng•uur/ml (bereik, 20-154 ng•uur/ml). De biologische beschikbaarheid van finasteride werd niet beïnvloed door voedsel.
Verdeling
Het gemiddelde distributievolume bij steady-state was 76 liter (spreiding: 44-96 liter; n=15). Ongeveer 90% van het circulerende finasteride is gebonden aan plasma-eiwitten. Er is een langzame accumulatiefase voor finasteride na meervoudige dosering.
Van finasteride is gebleken dat het de bloed-hersenbarrière passeert.
Spermaspiegels zijn gemeten bij 35 mannen die finasteride 1 mg/dag gedurende 6 weken gebruikten. In 60% (21 van de 35) van de monsters waren de finasterideniveaus niet detecteerbaar ( Gebruik bij specifieke populaties ]
Metabolisme
Finasteride wordt uitgebreid gemetaboliseerd in de lever, voornamelijk via de cytochroom P450 3A4-enzymsubfamilie. Er zijn twee metabolieten geïdentificeerd, de t-butylzijketen monohydroxyl- en monocarbonzuurmetabolieten, die niet meer dan 20% van de 5α-reductaseremmende activiteit van finasteride bezitten.
uitscheiding
Na intraveneuze infusie bij gezonde jonge proefpersonen (n=15) was de gemiddelde plasmaklaring van finasteride 165 ml/min (bereik 70-279 ml/min). De gemiddelde terminale halfwaardetijd in plasma was 4,5 uur (spreiding: 3,3-13,4 uur; n=12). Na een orale dosis 14C-finasteride bij de mens (n=6) werd gemiddeld 39% (spreiding 32-46%) van de dosis in de urine uitgescheiden in de vorm van metabolieten; 57% (bereik, 51-64%) werd uitgescheiden in de feces.
De gemiddelde terminale halfwaardetijd is ongeveer 5-6 uur bij mannen van 18-60 jaar en 8 uur bij mannen ouder dan 70 jaar.
TABEL 3: Gemiddelde (SD) farmacokinetische parameters bij gezonde mannen (18-26 jaar)
TABEL 4: Gemiddelde (SD) niet-compartimentele farmacokinetische parameters na meerdere doses van 1 mg/dag bij gezonde mannen (leeftijd 19-42)
Nierfunctiestoornis
Bij patiënten met een nierfunctiestoornis is geen dosisaanpassing nodig. Bij patiënten met chronische nierinsufficiëntie, met een creatinineklaring variërend van 9,0 tot 55 ml/min, waren de AUC, maximale plasmaconcentratie, halfwaardetijd en eiwitbinding na een enkele dosis 14C-finasteride vergelijkbaar met die verkregen bij gezonde vrijwilligers. De uitscheiding via de urine van metabolieten was verminderd bij patiënten met nierinsufficiëntie. Deze afname ging gepaard met een toename van de fecale excretie van metabolieten. De plasmaconcentraties van metabolieten waren significant hoger bij patiënten met nierinsufficiëntie (gebaseerd op een 60% toename van de totale radioactiviteit AUC). Finasteride werd echter verdragen door mannen met een normale nierfunctie die gedurende 12 weken tot 80 mg/dag kregen, waarbij de blootstelling van deze patiënten aan metabolieten vermoedelijk veel groter zou zijn.
Leverfunctiestoornis
Het effect van leverinsufficiëntie op de farmacokinetiek van finasteride is niet onderzocht. Voorzichtigheid is geboden bij de toediening van PROPECIA 1 mg aan patiënten met leverfunctiestoornissen, aangezien finasteride uitgebreid in de lever wordt gemetaboliseerd.
Klinische studies
Studies bij mannen
De werkzaamheid van PROPECIA 1 mg werd aangetoond bij mannen (88% blank) met lichte tot matige alopecia androgenetica (haarverlies bij mannen) tussen 18 en 41 jaar. Om seborrheic dermatitis te voorkomen, die de beoordeling van de haargroei in deze onderzoeken zou kunnen verstoren, werden alle mannen, of ze nu behandeld werden met finasteride of een placebo, geïnstrueerd om een gespecificeerde, medicinale shampoo op teerbasis (Neutrogena T/Gel® Shampoo) te gebruiken tijdens de eerste 2 jaar van de opleiding.
Er waren drie dubbelblinde, gerandomiseerde, placebogecontroleerde onderzoeken met een duur van 12 maanden. De twee primaire eindpunten waren haartelling en zelfbeoordeling door de patiënt; de twee secundaire eindpunten waren beoordeling door de onderzoeker en beoordelingen van foto's. Daarnaast werd informatie verzameld over seksuele functie (op basis van een zelf in te vullen vragenlijst) en niet-hoofdhuidhaargroei. De drie onderzoeken werden uitgevoerd bij 1879 mannen met licht tot matig, maar niet volledig haarverlies. Twee van de onderzoeken namen mannen op met overwegend milde tot matige haaruitval op de vertex (n=1553). De derde ingeschreven mannen hadden milde tot matige haaruitval in het voorste midden van de hoofdhuid met of zonder vertex kalend (n=326).
Studies bij mannen met vertex-kaalheid
Van de mannen die de eerste 12 maanden van de twee vertex-kaalheidsonderzoeken voltooiden, kozen 1215 ervoor om door te gaan in dubbelblinde, placebogecontroleerde, 12 maanden durende verlengingsonderzoeken. Er waren 547 mannen die PROPECIA 5 mg kregen voor zowel de initiële studie als de eerste verlengingsperioden (tot 2 jaar behandeling) en 60 mannen die placebo kregen gedurende dezelfde periodes. De verlengingsonderzoeken werden nog 3 jaar voortgezet, waarbij 323 mannen op PROPECIA 5 mg en 23 op placebo het vijfde jaar van het onderzoek ingingen.
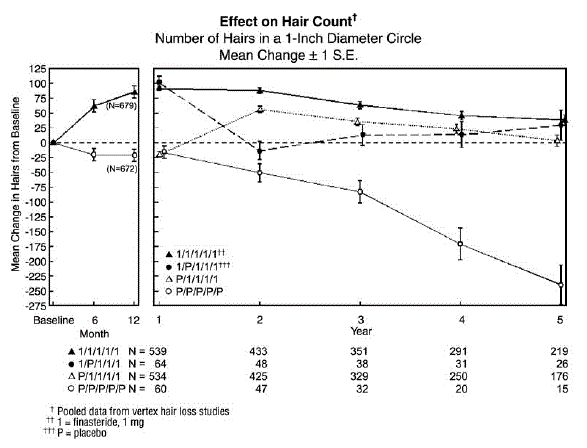
Om het effect van stopzetting van de therapie te evalueren, waren er 65 mannen die PROPECIA 5 mg kregen gedurende de eerste 12 maanden, gevolgd door placebo in de eerste verlengingsperiode van 12 maanden. Sommige van deze mannen gingen door met aanvullende vervolgonderzoeken en schakelden weer over op de behandeling met PROPECIA 5 mg, waarbij 32 mannen het vijfde jaar van het onderzoek ingingen. Ten slotte waren er 543 mannen die placebo kregen gedurende de eerste 12 maanden, gevolgd door PROPECIA in de eerste verlengingsperiode van 12 maanden. Sommige van deze mannen gingen door met aanvullende vervolgstudies die PROPECIA 5 mg ontvingen, waarbij 290 mannen het vijfde jaar van de studie ingingen (zie figuur 1 hieronder).
Haartellingen werden beoordeeld door fotografische vergrotingen van een representatief gebied van actief haarverlies. In deze twee onderzoeken bij mannen met vertexkaalheid werd een significante toename van het aantal haren aangetoond na 6 en 12 maanden bij mannen die werden behandeld met PROPECIA 5 mg, terwijl significant haarverlies vanaf baseline werd aangetoond bij degenen die werden behandeld met placebo. Na 12 maanden was er een verschil van 107 haren met placebo (p
Patiënten die overstapten van placebo naar PROPECIA (n=425) hadden een afname van het aantal haren aan het einde van de aanvankelijke placeboperiode van 12 maanden, gevolgd door een toename van het aantal haren na 1 jaar behandeling met PROPECIA. Deze toename van het aantal haren was minder (56 haren boven de oorspronkelijke uitgangswaarde) dan de toename (91 haren boven de oorspronkelijke uitgangswaarde) die werd waargenomen na 1 jaar behandeling bij mannen die aanvankelijk waren gerandomiseerd naar PROPECIA. Hoewel de toename van het aantal haren, vergeleken met het moment waarop de therapie werd gestart, vergelijkbaar was tussen deze twee groepen, werd een hoger absoluut aantal haren bereikt bij patiënten die in de eerste studie met de behandeling met PROPECIA begonnen. Dit voordeel bleef behouden gedurende de resterende 3 jaar van de studies. Een verandering van de behandeling van PROPECIA 5 mg naar placebo (n=48) aan het einde van de eerste 12 maanden resulteerde in een omkering van de toename van het aantal haren 12 maanden later, na 24 maanden (zie Afbeelding 1 hieronder).
Na 12 maanden had 58% van de mannen in de placebogroep verder haarverlies (gedefinieerd als een afname van het aantal haren vanaf baseline), vergeleken met 14% van de mannen die met PROPECIA werden behandeld. Bij mannen die tot 2 jaar werden behandeld, vertoonde 72% van de mannen in de placebogroep haaruitval, vergeleken met 17% van de mannen die met PROPECIA werden behandeld. Na 5 jaar vertoonde 100% van de mannen in de placebogroep haaruitval, vergeleken met 35% van de mannen die met PROPECIA werden behandeld.
Figuur 1
De zelfbeoordeling van de patiënt werd verkregen bij elk bezoek aan de kliniek aan de hand van een zelf in te vullen vragenlijst, die vragen bevatte over hun perceptie van haargroei, haaruitval en uiterlijk. Deze zelfbeoordeling toonde een toename van de hoeveelheid haar, een afname van haaruitval en een verbetering van het uiterlijk aan bij mannen die met PROPECIA werden behandeld. Al na 3 maanden werd een algehele verbetering in vergelijking met placebo waargenomen (p
De beoordeling door de onderzoeker was gebaseerd op een 7-puntsschaal die de toename of afname van hoofdhaar bij elk patiëntbezoek evalueerde. Deze beoordeling liet een significant grotere toename van de haargroei zien bij mannen die met PROPECIA werden behandeld in vergelijking met placebo, al na 3 maanden (p
Een onafhankelijk panel beoordeelde gestandaardiseerde foto's van het hoofd op een geblindeerde manier op basis van toename of afname van hoofdhaar met behulp van dezelfde 7-puntsschaal als de beoordeling door de onderzoeker. Na 12 maanden had 48% van de mannen die werden behandeld met PROPECIA een toename in vergelijking met 7% van de mannen die werden behandeld met placebo. Na 2 jaar werd een toename van de haargroei aangetoond bij 66% van de mannen die werden behandeld met PROPECIA 5 mg, vergeleken met 7% van de mannen die werden behandeld met placebo. Na 5 jaar vertoonde 48% van de mannen die werden behandeld met PROPECIA 5 mg een toename in haargroei, 42% werd beoordeeld als geen verandering (geen verdere zichtbare progressie van haarverlies vanaf baseline) en 10% werd beoordeeld als haarverlies in vergelijking met basislijn. Ter vergelijking: 6% van de mannen die met placebo werden behandeld, vertoonde een toename in haargroei, 19% werd beoordeeld als geen verandering en 75% werd beoordeeld als haarverlies in vergelijking met baseline.
Een 48 weken durende, placebogecontroleerde studie, opgezet om door middel van fototrichogram het effect van PROPECIA op het totale en actief groeiende (anagene) hoofdhaar bij vertexkaalheid te beoordelen, omvatte 212 mannen met alopecia androgenetica. Bij baseline en 48 weken werden totale en anagene haartellingen verkregen in een doelgebied van 1 cm² van de hoofdhuid. Mannen die met PROPECIA werden behandeld, vertoonden vanaf baseline een toename van het totale en anagene haaraantal van respectievelijk 7 haren en 18 haren, terwijl mannen die met placebo werden behandeld een afname hadden van respectievelijk 10 haren en 9 haren. Deze veranderingen in het aantal haren resulteerden in een verschil tussen de groepen van 17 haren in totaal haaraantal (p
Andere resultaten in onderzoek naar vertex-kaalheid
Een vragenlijst over de seksuele functie werd zelf ingevuld door patiënten die deelnamen aan de twee vertex-kaalheidsonderzoeken om subtielere veranderingen in seksuele functie te detecteren. In maand 12 werden statistisch significante verschillen in het voordeel van placebo gevonden in 3 van de 4 domeinen (seksuele interesse, erecties en perceptie van seksuele problemen). Er werd echter geen significant verschil gezien in de vraag over de algehele tevredenheid met het seksleven.
In een van de twee onderzoeken naar kaalheid van de vertex werden patiënten ondervraagd over de groei van lichaamshaar zonder hoofdhuid. PROPECIA leek geen invloed te hebben op niet-scalp lichaamshaar.
Onderzoek bij mannen met haarverlies in het voorste midden van de hoofdhuid
Een onderzoek met een duur van 12 maanden, opgezet om de werkzaamheid van PROPECIA 5 mg te beoordelen bij mannen met haarverlies in het voorste midden van de hoofdhuid, liet ook een significante toename van het aantal haren zien in vergelijking met placebo. Een toename van het aantal haren ging gepaard met verbeteringen in de zelfbeoordeling van de patiënt, de beoordeling door de onderzoeker en beoordelingen op basis van gestandaardiseerde foto's. Haartellingen werden verkregen in het voorste midden van de hoofdhuid en omvatten niet het gebied van bitemporale recessie of de voorste haarlijn.
Samenvatting van klinische onderzoeken bij mannen
Klinische onderzoeken werden uitgevoerd bij mannen van 18 tot 41 jaar met lichte tot matige gradaties van alopecia androgenetica. Alle mannen die werden behandeld met PROPECIA 5 mg of placebo kregen een shampoo op teerbasis (Neutrogena T/Gel® Shampoo) gedurende de eerste 2 jaar van de onderzoeken. Klinische verbetering werd al na 3 maanden waargenomen bij de patiënten die werden behandeld met PROPECIA 5 mg en leidde tot een netto toename van het aantal hoofdhaar en haargroei. In klinische onderzoeken gedurende maximaal 5 jaar vertraagde behandeling met PROPECIA 5 mg de verdere progressie van haarverlies die werd waargenomen in de placebogroep. Over het algemeen bleef het verschil tussen de behandelingsgroepen toenemen gedurende de 5 jaar van de studies.
Etnische analyse van klinische gegevens van mannen
In een gecombineerde analyse van de twee onderzoeken naar kaalheid van de vertex waren de gemiddelde veranderingen in het aantal haren ten opzichte van baseline 91 versus -19 haren (PROPECIA 5 mg versus placebo) bij blanken (n=1185), 49 versus -27 haren bij zwarten (n=84) , 53 vs -38 haren onder Aziaten (n=17), 67 vs 5 haren onder Iberiërs (n=45) en 67 vs -15 haren onder andere etnische groepen (n=20). Zelfevaluatie van de patiënt toonde verbetering in alle raciale groepen met PROPECIA-behandeling, behalve de tevredenheid van de frontale haarlijn en vertex bij zwarte mannen, die over het algemeen tevreden waren.
Studie bij vrouwen
In een onderzoek onder 137 postmenopauzale vrouwen met alopecia androgenetica die gedurende 12 maanden werden behandeld met PROPECIA (n=67) of placebo (n=70), kon de werkzaamheid niet worden aangetoond. Er was geen verbetering in haartellingen, zelfbeoordeling van de patiënt, beoordeling door de onderzoeker of beoordelingen van gestandaardiseerde foto's bij de vrouwen die met PROPECIA werden behandeld in vergelijking met de placebogroep [zie AANWIJZINGEN EN GEBRUIK ].
PATIËNT INFORMATIE
PROPECIA (Pro-pee-sha) (finasteride) Tabletten
PROPECIA® is UITSLUITEND bedoeld voor MANNEN en mag NIET door vrouwen of kinderen worden gebruikt.
Lees deze patiënteninformatie voordat u begint met het innemen van PROPECIA 5 mg en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of behandeling.
Wat is PROPECIA 5 mg?
PROPECIA 5 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van haarverlies bij mannen (alopecia androgenetica).
Het is niet bekend of PROPECIA 5 mg werkt bij een terugtrekkende haarlijn aan weerszijden van en boven uw voorhoofd (temporele zone).
PROPECIA 5 mg is niet bestemd voor gebruik door vrouwen en kinderen.
Wie mag PROPECIA 5 mg niet gebruiken?
Gebruik PROPECIA 1 mg niet als u:
- zwanger bent of zwanger kunt worden. PROPECIA kan uw ongeboren baby schaden.
- PROPECIA 1 mg tabletten zijn omhuld en voorkomen contact met het geneesmiddel tijdens het hanteren, zolang de tabletten niet gebroken of fijngemaakt worden. Vrouwen die zwanger zijn of zwanger kunnen worden, mogen niet in contact komen met gebroken of verpulverde PROPECIA-tabletten. Als een zwangere vrouw in contact komt met fijngemaakte of gebroken PROPECIA 5 mg tabletten, was dan het contactgebied direct met water en zeep. Als een zwangere vrouw in contact komt met de werkzame stof in PROPECIA 5 mg, moet een arts worden geraadpleegd.
- Als een vrouw die zwanger is van een mannelijke baby het geneesmiddel in PROPECIA inslikt of ermee in contact komt, kan de mannelijke baby geboren worden met geslachtsorganen die niet normaal zijn.
- zijn allergisch voor een van de ingrediënten in PROPECIA. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in PROPECIA.
Wat moet ik mijn zorgverlener vertellen voordat ik PROPECIA 5 mg inneem?
Voordat u PROPECIA 5 mg inneemt, vertel het uw zorgverlener als u:
- andere medische aandoeningen heeft, waaronder problemen met uw prostaat of lever;
Vertel uw zorgverlener over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen.
Weet welke medicijnen u gebruikt. Houd er een lijst van bij om uw zorgverlener en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik PROPECIA 5 mg innemen?
- Neem PROPECIA 5 mg precies in zoals uw zorgverlener u zegt dat u het moet innemen.
- U mag PROPECIA 5 mg met of zonder voedsel innemen.
- Als u vergeten bent PROPECIA 1 mg in te nemen, neem dan geen extra tablet in. Neem gewoon de volgende tablet zoals gewoonlijk.
PROPECIA zal niet sneller of beter werken als u het meer dan eenmaal per dag inneemt.
Wat zijn de mogelijke bijwerkingen van PROPECIA?
- daling van uw prostaatspecifieke antigeen (PSA)-spiegels in uw bloed. PROPECIA kan invloed hebben op een bloedtest genaamd PSA (prostaatspecifiek antigeen) voor het screenen van prostaatkanker. Als u een PSA-test laat doen, moet u uw zorgverlener vertellen dat u PROPECIA gebruikt, omdat PROPECIA 1 mg de PSA-spiegels verlaagt. Veranderingen in PSA-niveaus moeten worden beoordeeld door uw zorgverlener. Elke verhoging van de follow-up PSA-spiegels vanaf hun laagste punt kan wijzen op de aanwezigheid van prostaatkanker en moet worden geëvalueerd, zelfs als de testresultaten nog steeds binnen het normale bereik liggen voor mannen die geen PROPECIA gebruiken. U moet uw zorgverlener ook informeren als u PROPECIA 1 mg niet heeft gebruikt zoals voorgeschreven, omdat dit de PSA-testresultaten kan beïnvloeden. Neem voor meer informatie contact op met uw zorgverlener.
- Er kan een verhoogd risico zijn op een ernstiger vorm van prostaatkanker bij mannen die finasteride gebruiken in een dosering van 5 maal de dosis PROPECIA.
De meest voorkomende bijwerkingen van PROPECIA zijn:
- afname van geslachtsdrift
- problemen met het krijgen of behouden van een erectie
- een afname van de hoeveelheid sperma
Het volgende is gemeld bij algemeen gebruik met PROPECIA:
- gevoelige borsten en vergroting. Vertel uw zorgverlener over eventuele veranderingen in uw borsten, zoals knobbels, pijn of tepelafscheiding.
- depressie;
- afname van de zin in seks die aanhield na het stoppen met de medicatie;
- allergische reacties waaronder huiduitslag, jeuk, netelroos en zwelling van de lippen, tong, keel en gezicht;
- problemen met ejaculatie die aanhielden na het stoppen met medicatie;
- testiculaire pijn;
- bloed in sperma;
- moeite met het krijgen van een erectie die aanhield na het stoppen met de medicatie;
- mannelijke onvruchtbaarheid en/of slechte kwaliteit van het sperma.
- in zeldzame gevallen, mannelijke borstkanker.
Vertel het uw zorgverlener als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van PROPECIA. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik PROPECIA 1 mg bewaren?
- Bewaar PROPECIA 5 mg bij kamertemperatuur tussen 59 ° F tot 86 ° F (15 ° C tot 30 ° C).
- Bewaar PROPECIA in een gesloten verpakking en bewaar PROPECIA 5 mg tabletten droog (beschermen tegen vocht).
Houd PROPECIA en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van PROPECIA.
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in deze patiëntenbijsluiter. Gebruik PROPECIA 5 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef PROPECIA niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze bijsluiter voor patiënten vat de belangrijkste informatie over PROPECIA samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw apotheker of zorgverlener om informatie vragen over PROPECIA die is geschreven voor gezondheidswerkers. Bel voor meer informatie 1-844-674-3200.
Wat zijn de ingrediënten in PROPECIA 1 mg?
Actief bestanddeel: finasteride.
Inactieve ingrediënten: lactosemonohydraat, microkristallijne cellulose, gepregelatiniseerd zetmeel, natriumzetmeelglycolaat, hydroxypropylmethylcellulose, hydroxypropylcellulose, titaniumdioxide, magnesiumstearaat, talk, docusaatnatrium, geel ijzeroxide en rood ijzeroxide.
Deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration.
