Behandeling van haar: Avodart 0.5mg Dutasteride Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Avodart 0,5 mg en hoe wordt het gebruikt?
Avodart 0,5 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van een vergrote prostaat (goedaardige prostaathyperplasie) te behandelen. Avodart kan alleen of in combinatie met andere medicijnen worden gebruikt.
Avodart 0,5 mg behoort tot een klasse geneesmiddelen die 5-alfa-reductaseremmers worden genoemd.
Het is niet bekend of Avodart 0,5 mg veilig en effectief is bij kinderen.
Wat zijn bijwerkingen van Avodart?
Bijwerkingen van Avodart 0,5 mg zijn onder meer:
- netelroos,
- moeite met ademhalen,
- zwelling in uw gezicht of keel,
- koorts,
- keelpijn,
- brandende ogen,
- huidpijn, en
- rode of paarse huiduitslag met blaarvorming en vervelling
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Avodart 0,5 mg zijn:
- verminderd libido (zin in seks),
- verminderde hoeveelheid sperma die vrijkomt tijdens seks,
- impotentie (problemen met het krijgen of behouden van een erectie), en
- gevoelige of vergroting van de borsten
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Avodart. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
AVODART 0,5 mg is een synthetische 4-azasteroïde verbinding die een selectieve remmer is van zowel de type 1 als de type 2 isovormen van steroïde 5 alfa-reductase, een intracellulair enzym dat testosteron omzet in DHT.
Dutasteride wordt chemisch aangeduid als (5α,17β)-N-{2,5 bis(trifluormethyl)fenyl}-3-oxo-4-azaandrost-1-een-17-carboxamide. De empirische formule van dutasteride is C27H30F6N2O2, wat een molecuulgewicht van 528,5 vertegenwoordigt met de volgende structuurformule:
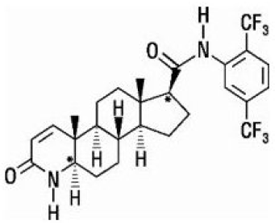
Dutasteride is een wit tot lichtgeel poeder met een smeltpunt van 242° tot 250°C. Het is oplosbaar in ethanol (44 mg/ml), methanol (64 mg/mL) en polyethyleenglycol 400 (3 mg/mL), maar het is onoplosbaar in water.
Elke AVODART 0,5 mg zachte gelatinecapsule, oraal toegediend, bevat 0,5 mg dutasteride opgelost in een mengsel van mono-diglyceriden van capryl/caprinezuur en gebutyleerd hydroxytolueen. De inactieve hulpstoffen in het omhulsel van de capsule zijn ijzeroxide (geel), gelatine (van gecertificeerde BSE-vrije runderbronnen), glycerine en titaniumdioxide. De zachte gelatinecapsules zijn bedrukt met eetbare rode inkt.
INDICATIES
Monotherapie
AVODART (dutasteride) zachte gelatinecapsules zijn geïndiceerd voor de behandeling van symptomatische goedaardige prostaathyperplasie (BPH) bij mannen met een vergrote prostaat om:
- symptomen verbeteren,
- het risico op acute urineretentie (AUR) verminderen, en
- het risico op de noodzaak van BPH-gerelateerde chirurgie te verminderen.
Combinatie met alfa-adrenerge antagonist
AVODART in combinatie met de alfa-adrenerge antagonist, tamsulosine, is geïndiceerd voor de behandeling van symptomatische BPH bij mannen met een vergrote prostaat.
Beperkingen van gebruik
AVODART 0,5 mg is niet goedgekeurd voor de preventie van prostaatkanker.
DOSERING EN ADMINISTRATIE
De capsules moeten in hun geheel worden doorgeslikt en mogen niet worden gekauwd of geopend, aangezien contact met de inhoud van de capsule kan leiden tot irritatie van het orofaryngeale slijmvlies. AVODART kan met of zonder voedsel worden toegediend.
Monotherapie
De aanbevolen dosis AVODART is 1 capsule (0,5 mg) eenmaal daags.
Combinatie met alfa-adrenerge antagonist
De aanbevolen dosering AVODART 0,5 mg is 1 capsule (0,5 mg) eenmaal daags en tamsulosine 0,4 mg eenmaal daags.
HOE GELEVERD
Doseringsvormen en sterke punten
0,5 mg, ondoorzichtige, dofgele, gelatinecapsules bedrukt met "GX CE2" in rode inkt aan één kant.
Opslag en behandeling
AVODART zachte gelatinecapsules van 0,5 mg zijn langwerpige, ondoorzichtige, dofgele gelatinecapsules bedrukt met “GX CE2” met rode eetbare inkt aan één zijde, verpakt in flessen van 30 ( NDC 0173-0712-15) en 90 ( NDC 0173-0712-04) met kindveilige sluitingen.
Bewaren bij 25°C (77°F); excursies toegestaan tot 15° tot 30°C (59° tot 86°F) [zie USP-gecontroleerde kamertemperatuur ].
Dutasteride wordt door de huid opgenomen. AVODART 0,5 mg capsules mogen niet worden gehanteerd door vrouwen die zwanger zijn of zwanger zouden kunnen worden vanwege de mogelijke absorptie van dutasteride en het daaruit voortvloeiende potentiële risico voor een zich ontwikkelende mannelijke foetus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gefabriceerd voor: GlaxoSmithKline Research Triangle Park. Herzien: januari 2020
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische proef met een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Uit klinische onderzoeken met AVODART 0,5 mg als monotherapie of in combinatie met tamsulosine:
- De meest voorkomende bijwerkingen die werden gemeld bij proefpersonen die AVODART 0, 5 mg kregen, waren impotentie, verminderd libido, borstaandoeningen (inclusief borstvergroting en gevoeligheid) en ejaculatiestoornissen. De meest voorkomende bijwerkingen die werden gemeld bij proefpersonen die combinatietherapie kregen (AVODART 0,5 mg plus tamsulosine) waren impotentie, verminderd libido, borstaandoeningen (waaronder borstvergroting en gevoeligheid), ejaculatiestoornissen en duizeligheid. Ejaculatiestoornissen kwamen significant vaker voor bij proefpersonen die combinatietherapie kregen (11%) in vergelijking met degenen die AVODART (2%) of tamsulosine (4%) als monotherapie kregen.
- Stopzetting van de proef vanwege bijwerkingen trad op bij 4% van de proefpersonen die AVODART 0, 5 mg kregen en bij 3% van de proefpersonen die placebo kregen in placebogecontroleerde onderzoeken met AVODART. De meest voorkomende bijwerking die leidde tot stopzetting van het onderzoek was impotentie (1%).
- In de klinische studie waarin de combinatietherapie werd geëvalueerd, trad stopzetting van de studie vanwege bijwerkingen op bij 6% van de proefpersonen die combinatietherapie (AVODART plus tamsulosine) kregen en bij 4% van de proefpersonen die AVODART 0,5 mg of tamsulosine als monotherapie kregen. De meest voorkomende bijwerking in alle behandelarmen die leidden tot stopzetting van de studie was erectiestoornis (1% tot 1,5%).
Monotherapie
Meer dan 4.300 mannelijke proefpersonen met BPH werden willekeurig toegewezen aan placebo of 0,5 mg dagelijkse doses AVODART in 3 identieke, placebogecontroleerde, dubbelblinde, fase 3-behandelingsonderzoeken van 2 jaar, elk gevolgd door een 2 jaar durende open-label verlenging. Tijdens de dubbelblinde behandelingsperiode werden 2.167 mannelijke proefpersonen blootgesteld aan AVODART 0,5 mg, waarvan 1772 gedurende 1 jaar en 1.510 gedurende 2 jaar. Wanneer de open-label extensies werden opgenomen, werden 1.009 mannelijke proefpersonen gedurende 3 jaar blootgesteld aan AVODART 0,5 mg en 812 gedurende 4 jaar. De bevolking was 47 tot 94 jaar oud (gemiddelde leeftijd: 66 jaar) en meer dan 90% was blank. Tabel 1 geeft een overzicht van klinische bijwerkingen die zijn gemeld bij ten minste 1% van de proefpersonen die AVODART kregen en met een hogere incidentie dan proefpersonen die placebo kregen.
Langdurige behandeling (tot 4 jaar)
Hoogwaardige prostaatkanker
De REDUCE-studie was een gerandomiseerde, dubbelblinde, placebogecontroleerde studie waaraan 8.231 mannen van 50 tot 75 jaar deelnamen met een serum-PSA van 2,5 ng/ml tot 10 ng/ml en een negatieve prostaatbiopsie in de voorafgaande 6 maanden. De proefpersonen werden gerandomiseerd om placebo (n = 4.126) of 0,5 mg dagelijkse doses AVODART (n = 4.105) te krijgen gedurende maximaal 4 jaar. De gemiddelde leeftijd was 63 jaar en 91% was blank. De proefpersonen ondergingen protocol-gemandateerde geplande prostaatbiopten na 2 en 4 jaar behandeling of hadden "voor de oorzaak biopsieën" op niet-geplande tijdstippen indien klinisch geïndiceerd. Er was een hogere incidentie van Gleason-score 8-10 prostaatkanker bij mannen die AVODART kregen (1,0%) in vergelijking met mannen die placebo kregen (0,5%) [zie AANWIJZINGEN EN GEBRUIK , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. In een 7 jaar durend placebogecontroleerd klinisch onderzoek met een andere 5 alfa-reductaseremmer (finasteride 5 mg, PROSCAR), werden vergelijkbare resultaten voor Gleason-score 8-10 prostaatkanker waargenomen (finasteride 1,8% versus placebo 1,1%).
Er is geen klinisch voordeel aangetoond bij patiënten met prostaatkanker die met AVODART worden behandeld.
Voortplantings- en borstaandoeningen
In de 3 belangrijkste placebogecontroleerde BPH-onderzoeken met AVODART 0,5 mg, die elke 4 jaar duurden, waren er geen aanwijzingen voor toegenomen seksuele bijwerkingen (impotentie, verminderd libido en ejaculatiestoornis) of borstaandoeningen bij een langere behandelingsduur. Van deze 3 onderzoeken was er 1 geval van borstkanker in de dutasteridegroep en 1 geval in de placebogroep. In de 4-jarige CombAT-studie of de 4-jarige REDUCE-studie werden in geen enkele behandelingsgroep gevallen van borstkanker gemeld.
De relatie tussen langdurig gebruik van dutasteride en mannelijke borstneoplasie is momenteel niet bekend.
Combinatie met alfablokkertherapie (CombAT)
Meer dan 4.800 mannelijke proefpersonen met BPH werden willekeurig toegewezen aan 0,5 mg AVODART 0,5 mg, 0,4 mg tamsulosine of combinatietherapie (0,5 mg AVODART plus 0,4 mg tamsulosine) eenmaal daags toegediend in een 4-jarige dubbelblinde studie. In totaal kregen 1.623 proefpersonen monotherapie met AVODART; 1.611 proefpersonen kregen monotherapie met tamsulosine; en 1.610 proefpersonen kregen combinatietherapie. De bevolking was 49 tot 88 jaar oud (gemiddelde leeftijd: 66 jaar) en 88% was blank. Tabel 2 geeft een overzicht van bijwerkingen die zijn gemeld bij ten minste 1% van de proefpersonen in de combinatiegroep en met een hogere incidentie dan proefpersonen die monotherapie kregen met AVODART 0,5 mg of tamsulosine.
Hartfalen
In CombAT was na 4 jaar behandeling de incidentie van de samengestelde term hartfalen in de combinatietherapiegroep (12/1.610; 0,7%) hoger dan in beide monotherapiegroepen: AVODART 0,5 mg, 2/1.623 (0,1%) en tamsulosine, 9/1.611 (0,6%). Samengesteld hartfalen werd ook onderzocht in een afzonderlijke 4-jarige placebogecontroleerde studie ter evaluatie van AVODART bij mannen met een risico op het ontwikkelen van prostaatkanker. De incidentie van hartfalen bij proefpersonen die 0,5 mg AVODART gebruikten, was 0,6% (26/4.105) vergeleken met 0,4% (15/4.126) bij proefpersonen die placebo kregen. Een meerderheid van de proefpersonen met hartfalen in beide onderzoeken had comorbiditeiten die verband hielden met een verhoogd risico op hartfalen. Daarom is de klinische betekenis van de numerieke onevenwichtigheden bij hartfalen onbekend. Er is geen causaal verband vastgesteld tussen AVODART alleen of in combinatie met tamsulosine en hartfalen. In beide onderzoeken werd geen onbalans waargenomen in de incidentie van algemene cardiovasculaire bijwerkingen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van AVODART na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen. Deze reacties zijn gekozen voor opname vanwege een combinatie van hun ernst, frequentie van rapportage of mogelijk causaal verband met AVODART.
Immuunsysteemaandoeningen
Overgevoeligheidsreacties, waaronder uitslag, pruritus, urticaria, gelokaliseerd oedeem, ernstige huidreacties en angio-oedeem.
neoplasmata
Mannelijke borstkanker.
Psychische stoornissen
Depressieve bui.
Voortplantingsstelsel- en borstaandoeningen
Testiculaire pijn en zwelling van de testikels.
DRUG-INTERACTIES
Cytochroom P450 3A-remmers
Dutasteride wordt bij de mens uitgebreid gemetaboliseerd door de cytochroom P450 (CYP)3A4- en CYP3A5-iso-enzymen. Het effect van krachtige CYP3A4-remmers op dutasteride is niet onderzocht. Vanwege het potentieel voor geneesmiddelinteracties, moet u voorzichtig zijn bij het voorschrijven van AVODART aan patiënten die krachtige, chronische CYP3A4-enzymremmers gebruiken (bijv. ritonavir) (zie KLINISCHE FARMACOLOGIE ].
Alfa-adrenerge antagonisten
De toediening van AVODART in combinatie met tamsulosine of terazosine heeft geen effect op de steady-state farmacokinetiek van een van beide alfa-adrenerge antagonisten. Het effect van toediening van tamsulosine of terazosine op de farmacokinetische parameters van dutasteride is niet onderzocht.
Calciumkanaalantagonisten
Gelijktijdige toediening van verapamil of diltiazem vermindert de klaring van dutasteride en leidt tot een verhoogde blootstelling aan dutasteride. De verandering in blootstelling aan dutasteride wordt niet als klinisch significant beschouwd. Er wordt geen dosisaanpassing aanbevolen [zie KLINISCHE FARMACOLOGIE ].
cholestyramine
Toediening van een enkele dosis van 5 mg AVODART 0,5 mg, 1 uur later gevolgd door 12 g colestyramine, heeft geen invloed op de relatieve biologische beschikbaarheid van dutasteride (zie KLINISCHE FARMACOLOGIE ].
Digoxine
AVODART 0,5 mg verandert de steady-state farmacokinetiek van digoxine niet bij gelijktijdige toediening in een dosis van 0,5 mg/dag gedurende 3 weken (zie KLINISCHE FARMACOLOGIE ].
Warfarine
Gelijktijdige toediening van AVODART 0,5 mg/dag gedurende 3 weken met warfarine verandert de steady-state farmacokinetiek van de S- of R-warfarine-isomeren niet of verandert het effect van warfarine op de protrombinetijd niet (zie KLINISCHE FARMACOLOGIE ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Effecten op prostaatspecifiek antigeen (PSA) en het gebruik van PSA bij de detectie van prostaatkanker
In klinische onderzoeken verminderde AVODART 0,5 mg de serum-PSA-concentratie met ongeveer 50% binnen 3 tot 6 maanden behandeling. Deze afname was voorspelbaar over het gehele bereik van PSA-waarden bij proefpersonen met symptomatische BPH, hoewel deze bij individuen kan variëren. AVODART 0,5 mg kan ook verlagingen van de serum-PSA veroorzaken in aanwezigheid van prostaatkanker. Om seriële PSA's te interpreteren bij mannen die AVODART 0,5 mg gebruiken, moet ten minste 3 maanden na aanvang van de behandeling een nieuwe PSA-basislijn worden vastgesteld en daarna moet de PSA periodiek worden gecontroleerd. Elke bevestigde stijging van de laagste PSA-waarde tijdens het gebruik van AVODART kan wijzen op de aanwezigheid van prostaatkanker en moet worden geëvalueerd, zelfs als de PSA-waarden nog steeds binnen het normale bereik liggen voor mannen die geen 5-alfareductaseremmer gebruiken. Niet-naleving van AVODART kan ook de PSA-testresultaten beïnvloeden.
Om een geïsoleerde PSA-waarde te interpreteren bij een man die gedurende 3 maanden of langer met AVODART 0,5 mg is behandeld, moet de PSA-waarde worden verdubbeld ter vergelijking met normale waarden bij onbehandelde mannen. De verhouding vrij-totaal PSA (percentage vrij PSA) blijft constant, ook onder invloed van AVODART. Als clinici ervoor kiezen om procent gratis PSA te gebruiken als hulpmiddel bij de detectie van prostaatkanker bij mannen die AVODART krijgen, lijkt het niet nodig om de waarde ervan aan te passen.
Gelijktijdige toediening van dutasteride en tamsulosine resulteerde in vergelijkbare veranderingen in serum-PSA als dutasteride monotherapie.
Verhoogd risico op hoogwaardige prostaatkanker
Bij mannen van 50 tot 75 jaar met een eerdere negatieve biopsie voor prostaatkanker en een baseline PSA tussen 2,5 ng/ml en 10,0 ng/ml die AVODART gebruikten in de 4-jarige Reduction by Dutasteride of Prostate Cancer Events (REDUCE)-studie, was er een verhoogde incidentie van Gleason-score 810 prostaatkanker vergeleken met mannen die placebo gebruikten (AVODART 1,0% versus placebo 0,5%) [zie AANWIJZINGEN EN GEBRUIK , ONGEWENSTE REACTIES ]. In een 7 jaar durend placebogecontroleerd klinisch onderzoek met een andere 5 alfa-reductaseremmer (finasteride 5 mg, PROSCAR), werden vergelijkbare resultaten voor Gleason-score 8-10 prostaatkanker waargenomen (finasteride 1,8% versus placebo 1,1%).
5-alfa-reductaseremmers kunnen het risico op het ontwikkelen van hooggradige prostaatkanker verhogen. Of het effect van 5-alfa-reductaseremmers om het prostaatvolume te verminderen of onderzoeksgerelateerde factoren de resultaten van deze onderzoeken beïnvloedden, is niet vastgesteld.
Evaluatie voor andere urologische ziekten
Voordat de behandeling met AVODART 0,5 mg wordt gestart, moet rekening worden gehouden met andere urologische aandoeningen die vergelijkbare symptomen kunnen veroorzaken. Bovendien kunnen BPH en prostaatkanker naast elkaar bestaan.
Transdermale blootstelling van AVODART 0,5 mg bij zwangere vrouwen - risico voor mannelijke foetus
AVODART-capsules mogen niet worden gehanteerd door vrouwen die zwanger zijn of mogelijk zwanger zijn. Dutasteride kan door de huid worden opgenomen en kan leiden tot onbedoelde blootstelling van de foetus en mogelijk risico voor een mannelijke foetus. Als een zwangere vrouw in contact komt met lekkende dutasteride-capsules, moet het contactgebied onmiddellijk worden gewassen met water en zeep [zie Gebruik bij specifieke populaties ]. Dutasteride kan door de huid worden opgenomen op basis van dierstudies [zie Niet-klinische toxicologie ].
Bloed donatie
Mannen die met AVODART worden behandeld, mogen geen bloed doneren tot ten minste 6 maanden na hun laatste dosis. Het doel van deze uitgestelde periode is om toediening van dutasteride aan een zwangere vrouwelijke transfusieontvanger te voorkomen.
Effect op spermakenmerken
De effecten van dutasteride 0,5 mg/dag op de spermakenmerken werden geëvalueerd bij gezonde mannen gedurende 52 weken behandeling en 24 weken follow-up na de behandeling. Na 52 weken resulteerde behandeling met dutasteride, vergeleken met placebo, in een gemiddelde afname van het totale aantal zaadcellen, het spermavolume en de beweeglijkheid van het sperma; de effecten op het totale aantal zaadcellen waren niet omkeerbaar na 24 weken follow-up. De spermaconcentratie en de spermamorfologie werden niet beïnvloed en de gemiddelde waarden voor alle spermaparameters bleven op alle tijdstippen binnen het normale bereik. De klinische betekenis van het effect van dutasteride op de spermakenmerken voor de vruchtbaarheid van een individuele patiënt is niet bekend [zie Gebruik bij specifieke populaties ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
PSA-bewaking
Informeer patiënten dat AVODART de serum-PSA-spiegels binnen 3 tot 6 maanden therapie met ongeveer 50% verlaagt, hoewel dit voor elk individu kan verschillen. Bij patiënten die PSA-screening ondergaan, kunnen verhogingen van de PSA-spiegels tijdens de behandeling met AVODART wijzen op de aanwezigheid van prostaatkanker en moeten worden beoordeeld door een zorgverlener [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Verhoogd risico op hoogwaardige prostaatkanker
Patiënten informeren dat er een toename was van hooggradige prostaatkanker bij mannen die werden behandeld met 5 alfa-reductaseremmers (die zijn geïndiceerd voor behandeling met BPH), waaronder 0,5 mg AVODART, vergeleken met degenen die werden behandeld met placebo in onderzoeken naar het gebruik van deze medicijnen om het risico op prostaatkanker te verminderen [zie AANWIJZINGEN EN GEBRUIK , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES ].
Transdermale blootstelling van AVODART bij zwangere of mogelijk zwangere vrouwen - risico voor mannelijke foetus
Informeer patiënten dat AVODART 0,5 mg capsules niet mogen worden gehanteerd door vrouwen die zwanger zijn of mogelijk zwanger kunnen zijn vanwege de mogelijke absorptie van dutasteride en het daaruit voortvloeiende potentiële risico voor een zich ontwikkelende mannelijke foetus. Dutasteride kan door de huid worden opgenomen en kan leiden tot onbedoelde blootstelling van de foetus. Als een zwangere of mogelijk zwangere vrouw in contact komt met lekkende AVODART 0,5 mg capsules, moet het contactgebied onmiddellijk worden gewassen met water en zeep [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties ].
Effecten op spermaparameters
Adviseer mannen dat AVODART 0,5 mg de kenmerken van het sperma kan beïnvloeden, maar dat het effect op de vruchtbaarheid niet bekend is [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties ].
Bloed donatie
Informeer mannen die worden behandeld met AVODART 0,5 mg dat ze geen bloed mogen doneren tot ten minste 6 maanden na hun laatste dosis om te voorkomen dat zwangere vrouwen dutasteride krijgen via bloedtransfusie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Serumspiegels van dutasteride zijn detecteerbaar gedurende 4 tot 6 maanden nadat de behandeling is beëindigd [zie KLINISCHE FARMACOLOGIE ].
AVODART is een handelsmerk dat eigendom is van of in licentie is gegeven aan de GSK-bedrijvengroep.
De andere vermelde merken zijn handelsmerken die eigendom zijn van of in licentie zijn gegeven aan hun respectievelijke eigenaren en zijn geen eigendom van of in licentie gegeven aan de GSK-bedrijvengroep. De makers van deze merken zijn niet gelieerd aan en onderschrijven de GSK-bedrijvengroep of haar producten niet.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Er werd een carcinogeniteitsonderzoek van 2 jaar uitgevoerd bij B6C3F1-muizen in doses van 3, 35, 250 en 500 mg/kg/dag voor mannetjes en 3, 35 en 250 mg/kg/dag voor vrouwtjes; alleen bij vrouwelijke muizen werd een verhoogde incidentie van goedaardige hepatocellulaire adenomen waargenomen bij 250 mg/kg/dag (290 maal de MRHD van een dagelijkse dosis van 0,5 mg). Twee van de drie belangrijkste menselijke metabolieten zijn gedetecteerd bij muizen. De blootstelling aan deze metabolieten bij muizen is ofwel lager dan bij mensen of is niet bekend.
In een 2 jaar durende carcinogeniteitsstudie bij Han Wistar-ratten, bij doses van 1,5, 7,5 en 53 mg/kg/dag bij mannetjes en 0,8, 6,3 en 15 mg/kg/dag bij vrouwtjes, was er een toename van Leydig-cel adenomen in de testikels bij 135 maal de MRHD (53 mg/kg/dag en hoger). Een verhoogde incidentie van Leydig-celhyperplasie was aanwezig bij een 52-voudige MRHD (doses van mannelijke ratten van 7,5 mg/kg/dag en hoger). Een positieve correlatie tussen proliferatieve veranderingen in de Leydig-cellen en een verhoging van de circulerende luteïniserend hormoonspiegels is aangetoond met 5-alfa-reductaseremmers en komt overeen met een effect op de hypothalamus-hypofyse-testiculaire as na 5-alfa-reductaseremming. Bij tumorigene doses waren de luteïniserend hormoonspiegels bij ratten met 167% verhoogd. In deze studie werden de belangrijkste menselijke metabolieten getest op carcinogeniteit bij ongeveer 1 tot 3 keer de verwachte klinische blootstelling.
Mutagenese
Dutasteride werd getest op genotoxiciteit in een bacteriële mutagenesetest (Ames-test), een chromosomale aberratietest in ovariumcellen van Chinese hamsters en een micronucleustest bij ratten. De resultaten wezen niet op enig genotoxisch potentieel van het oorspronkelijke geneesmiddel. Twee belangrijke menselijke metabolieten waren ook negatief in de Ames-test of een verkorte Ames-test.
Aantasting van de vruchtbaarheid
Behandeling van geslachtsrijpe mannelijke ratten met dutasteride met 0,1 maal de MRHD (dierdoses van 0,05 mg/kg/dag of meer gedurende maximaal 31 weken) op basis van de gemiddelde serumconcentratie resulteerde in dosis- en tijdafhankelijke afnames van de vruchtbaarheid bij alle doses ; verminderd aantal cauda epididymale (absolute) zaadcellen maar niet de spermaconcentratie (bij 50 en 500 mg/kg/dag); verminderd gewicht van de bijbal, prostaat en zaadblaasjes; en microscopische veranderingen (cytoplasmatische vacuolatie van tubulair epitheel in de epididymiden en/of verlaagd cytoplasmatisch gehalte van epitheel, consistent met verminderde secretoire activiteit in de prostaat en zaadblaasjes) in de voortplantingsorganen bij alle doses zonder vaderlijke toxiciteit. De effecten op de vruchtbaarheid waren bij alle doses in herstelweek 6 ongedaan gemaakt en het aantal zaadcellen was normaal aan het einde van een herstelperiode van 14 weken. De microscopische veranderingen waren niet meer aanwezig in herstelweek 14 bij 0,1 maal de MRHD en werden gedeeltelijk hersteld in de overige behandelgroepen. Lage dutasteridegehaltes (0,6 tot 17 ng/ml) werden gedetecteerd in het serum van onbehandelde vrouwelijke ratten die gepaard waren met behandelde mannetjes (10 tot 500 mg/kg/dag gedurende 29 tot 30 weken), wat 16 tot 110 keer de MRHD is op basis van gemiddelde serumconcentratie. Er trad geen vervrouwelijking op bij mannelijke nakomelingen van onbehandelde vrouwelijke ratten die gepaard waren met behandelde mannelijke ratten, hoewel detecteerbare bloedspiegels van dutasteride werden waargenomen bij de vrouwelijke ratten.
In een vruchtbaarheidsonderzoek bij vrouwelijke ratten met een dosering van 4 weken voorafgaand aan de paring tot een vroege dracht, resulteerde orale toediening van dutasteride in doses van 0,05, 2,5, 12,5 en 30 mg/kg/dag in een kleinere worpgrootte als gevolg van verhoogde resorpties en in feminisering. van mannelijke foetussen (verminderde anogenitale afstand) bij 2 tot 10 keer de MRHD (dierdoses van 2,5 mg/kg/dag of hoger) op basis van de gemiddelde serumconcentratie, in aanwezigheid van maternale toxiciteit (verminderde lichaamsgewichtstoename). Het lichaamsgewicht van de foetus was ook verminderd met ongeveer 0,02 keer de MRHD (dosis bij ratten van 0,05 mg/kg/dag of hoger) op basis van de gemiddelde serumconcentratie, zonder niveau zonder effect, in afwezigheid van maternale toxiciteit.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
AVODART 0,5 mg is gecontra-indiceerd voor gebruik tijdens de zwangerschap omdat het schadelijk kan zijn voor de mannelijke foetus [zie: CONTRA-INDICATIES ]. AVODART is niet geïndiceerd voor gebruik bij vrouwen.
AVODART 0,5 mg is een 5-alfa-reductaseremmer die de omzetting van testosteron in dihydrotestosteron (DHT), een hormoon dat nodig is voor de normale ontwikkeling van mannelijke genitaliën, voorkomt. Afwijkingen in de genitaliën van mannelijke foetussen zijn een verwacht fysiologisch gevolg van remming van deze omzetting. Deze resultaten zijn vergelijkbaar met waarnemingen bij mannelijke zuigelingen met genetische 5-alfa-reductasedeficiëntie.
In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
In reproductieonderzoeken bij dieren remde dutasteride de normale ontwikkeling van uitwendige genitaliën bij mannelijke nakomelingen wanneer het werd toegediend aan ratten of konijnen tijdens de organogenese in een dosering van minder dan de maximaal aanbevolen dosis voor de mens (MRHD) van 0,5 mg per dag, bij afwezigheid van maternale toxiciteit. Bij 15 keer de MRHD werden bij ratten een verlengde zwangerschap, een verminderd gewicht van de voortplantingsorganen en een vertraagde puberteit bij mannelijke nakomelingen waargenomen, met niveaus zonder effect van minder dan de MRHD van 0,5 mg per dag. Verhoogd placentagewicht bij konijnen werd ook waargenomen, met niveaus zonder effect van minder dan de MRHD van 0,5 mg per dag (zie Gegevens ).
Hoewel dutasteride in menselijk sperma wordt uitgescheiden, is de geneesmiddelconcentratie bij de menselijke vrouwelijke partner ongeveer 100 keer lager dan de concentraties die afwijkingen van de mannelijke genitaliën veroorzaken in dierstudies (zie Gegevens ). Bij apen die tijdens de organogenese werden gedoseerd in bloedconcentraties die vergelijkbaar zijn met of hoger zijn dan de niveaus waaraan een menselijke vrouwelijke partner naar schatting wordt blootgesteld, werden de externe genitaliën van mannelijke nakomelingen niet nadelig beïnvloed. Er trad geen vervrouwelijking op bij mannelijke nakomelingen van onbehandelde vrouwelijke ratten die gepaard waren met behandelde mannelijke ratten, hoewel detecteerbare bloedspiegels van dutasteride werden waargenomen bij de vrouwelijke ratten [zie Niet-klinische toxicologie ].
Gegevens
Menselijke gegevens
De hoogst gemeten spermaconcentratie van dutasteride bij behandelde mannen was 14 ng/ml. Hoewel dutasteride wordt aangetroffen in sperma, uitgaande van blootstelling van een vrouw van 50 kg aan 5 ml sperma en 100% absorptie, zou de verwachte dutasterideconcentratie in het bloed van de vrouw via sperma ongeveer 0,0175 ng/ml zijn. Deze concentratie is ongeveer 100 keer lager dan de bloedconcentraties die afwijkingen van de mannelijke genitaliën veroorzaken in dierstudies. Dutasteride is sterk eiwitgebonden in menselijk sperma (meer dan 96%), wat de hoeveelheid dutasteride die beschikbaar is voor vaginale absorptie kan verminderen.
Dierlijke gegevens
In een embryo-foetale ontwikkelingsstudie bij ratten resulteerde orale toediening van dutasteride in een dosering van 10 keer minder dan de MRHD van 0,5 mg per dag (gebaseerd op de gemiddelde bloedspiegels bij mannen) in feminisering van de mannelijke genitaliën bij de foetus (verminderde anogenitale afstand bij 0,05 mg /kg/dag, met een gebrek aan een no-effect niveau) bij afwezigheid van maternale toxiciteit. Bovendien traden tepelontwikkeling, hypospadie en opgezwollen voorhuidklieren op bij foetussen van moederdieren die werden behandeld met doses van 2,5 mg/kg/dag of meer (ongeveer 15 keer de MRHD). Een verminderd foetaal lichaamsgewicht en bijbehorende vertraagde ossificatie in aanwezigheid van maternale toxiciteit (verminderde toename van het lichaamsgewicht) werden waargenomen bij blootstelling van de moeder aan ongeveer 15 maal de MRHD (dosis van 2,5 mg/kg/dag of hoger). Een toename van doodgeboren jongen werd waargenomen bij moederdieren die werden behandeld met 30 mg/kg/dag (ongeveer 111 maal de MRHD), met een niveau zonder effect van 12,5 mg/kg/dag.
In een embryo-foetale ontwikkelingsstudie bij konijnen werden doses van 28 keer de MRHD (doses van 30 mg/kg/dag of hoger), gebaseerd op de gemiddelde bloedspiegels bij mannen, oraal toegediend op drachtdagen 7 tot 29 (tijdens periode van ontwikkeling van de uitwendige genitaliën). Histologische evaluatie van de genitale papilla van foetussen bracht bewijs aan het licht van feminisering van de mannelijke foetus, evenals gefuseerde schedelbotten en verhoogd placentagewicht bij alle doses in afwezigheid van maternale toxiciteit. Een tweede embryo-foetale ontwikkelingsstudie bij konijnen die gedurende de hele zwangerschap werden gedoseerd (organogenese en latere periode van ontwikkeling van de uitwendige genitaliën [Draagdag 6 tot 29]) met 0,3 maal de MRHD (doses van 0,05 mg/kg/dag of meer, zonder effectniveau), leverden ook bewijs op van vervrouwelijking van de genitaliën bij mannelijke foetussen en een verhoogd gewicht van de placenta bij alle doses in afwezigheid van maternale toxiciteit.
In een embryo-foetale ontwikkelingsstudie werden zwangere resusapen intraveneus blootgesteld tijdens de organogenese (draagtijd 20 tot 100) aan een dutasteride-bloedspiegel vergelijkbaar met of hoger dan de geschatte dutasterideblootstelling van een menselijke vrouwelijke partner. Dutasteride werd toegediend op drachtdagen 20 tot 100 (tijdens organogenese) in doses van 400, 780, 1.325 of 2.010 ng/dag (12 apen/groep). Er werd geen feminisering van mannelijke uitwendige genitaliën van nakomelingen van apen waargenomen. Bij de hoogste geteste dosis werden vermindering van het gewicht van de foetale bijnieren, een vermindering van het gewicht van de foetale prostaat en een toename van het gewicht van de foetus van de eierstokken en de testis waargenomen. Gebaseerd op de hoogst gemeten spermaconcentratie van dutasteride bij behandelde mannen (14 ng/ml), vertegenwoordigen deze doses bij de aap tot 16 keer de potentiële maximale blootstelling van een vrouw van 50 kg aan 5 ml sperma per dag van een dutasteride- behandelde man, uitgaande van 100% absorptie. De dosisniveaus (op basis van ng/kg) die in dit onderzoek aan apen worden toegediend, zijn 32 tot 186 keer de nominale (ng/kg) dosis waaraan een vrouwtje mogelijk via het sperma zou worden blootgesteld. Het is niet bekend of konijnen of resusapen een van de belangrijkste menselijke metabolieten produceren.
In een orale pre- en postnatale ontwikkelingsstudie bij ratten werd feminisering van de mannelijke genitaliën waargenomen. Een verminderde anogenitale afstand werd waargenomen bij 0,05 keer de MRHD en hoger (0,05 mg/kg/dag en hoger), met een gebrek aan een niveau zonder effect, gebaseerd op gemiddelde bloedspiegels bij mannen als schatting van de AUC. Hypospadie en tepelontwikkeling werden waargenomen bij 2,5 mg/kg/dag of meer (14 keer de MRHD of hoger, met een niveau zonder effect bij 0,05 mg/kg/dag). Doses van 2,5 mg/kg/dag en meer resulteerden ook in een verlengde dracht bij de moederlijke vrouwtjes, een toename van de tijd tot balano-preputiale scheiding bij mannelijke nakomelingen, een afname van de tijd tot vaginale doorgankelijkheid voor vrouwelijke nakomelingen, en een afname van prostaat- en zaadblaasjesgewichten bij mannelijke nakomelingen. Verhoogde doodgeboorten en verminderde neonatale levensvatbaarheid bij nakomelingen werden waargenomen bij 30 mg / kg / dag (102 keer de MRHD in aanwezigheid van maternale toxiciteit [verminderd lichaamsgewicht]).
Borstvoeding
Risico Samenvatting
AVODART is niet geïndiceerd voor gebruik bij vrouwen. Er is geen informatie beschikbaar over de aanwezigheid van dutasteride in moedermelk, de effecten op het kind dat borstvoeding krijgt of de effecten op de melkproductie.
Vrouwtjes en mannetjes met reproductief potentieel
Onvruchtbaarheid
mannen
De effecten van dutasteride 0,5 mg/dag op de spermakenmerken werden geëvalueerd bij normale vrijwilligers in de leeftijd van 18 tot 52 jaar (n = 27 dutasteride, n = 23 placebo) gedurende 52 weken behandeling en 24 weken follow-up na behandeling. Na 52 weken waren de gemiddelde procentuele afnames ten opzichte van baseline in het totale aantal zaadcellen, het spermavolume en de beweeglijkheid van het sperma respectievelijk 23%, 26% en 18% in de dutasteridegroep wanneer gecorrigeerd voor veranderingen ten opzichte van baseline in de placebogroep. Spermaconcentratie en spermamorfologie waren onaangetast. Na 24 weken follow-up bleef de gemiddelde procentuele verandering in het totale aantal zaadcellen in de dutasteridegroep 23% lager dan de uitgangswaarde. Hoewel de gemiddelde waarden voor alle spermaparameters op alle tijdstippen binnen het normale bereik bleven en niet voldeden aan de vooraf gedefinieerde criteria voor een klinisch significante verandering (30%), hadden 2 proefpersonen in de dutasteridegroep een afname van het aantal zaadcellen van meer dan 90% ten opzichte van baseline bij 52 weken, met gedeeltelijk herstel bij de follow-up van 24 weken. De klinische betekenis van het effect van dutasteride op de spermakenmerken voor de vruchtbaarheid van een individuele patiënt is niet bekend [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Pediatrisch gebruik
AVODART 0,5 mg is niet geïndiceerd voor gebruik bij pediatrische patiënten. De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Van de 2.167 mannelijke proefpersonen die in 3 klinische onderzoeken met AVODART 0,5 mg werden behandeld, was 60% 65 jaar en ouder en 15% 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten [zie KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Er is geen dosisaanpassing nodig voor AVODART 0,5 mg bij patiënten met nierinsufficiëntie [zie: KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
Het effect van leverinsufficiëntie op de farmacokinetiek van dutasteride is niet onderzocht. Omdat dutasteride uitgebreid wordt gemetaboliseerd, kan de blootstelling hoger zijn bij patiënten met een leverfunctiestoornis. In een klinisch onderzoek waarbij 60 proefpersonen gedurende 24 weken dagelijks 5 mg (10 maal de therapeutische dosis) kregen, werden echter geen bijkomende bijwerkingen waargenomen in vergelijking met de bijwerkingen die werden waargenomen bij de therapeutische dosis van 0,5 mg [zie KLINISCHE FARMACOLOGIE ].
OVERDOSERING
In onderzoeken met vrijwilligers zijn enkelvoudige doses dutasteride tot 40 mg (80 maal de therapeutische dosis) gedurende 7 dagen toegediend zonder significante veiligheidsproblemen. In een klinisch onderzoek werden gedurende 6 maanden dagelijkse doses van 5 mg (10 maal de therapeutische dosis) toegediend aan 60 proefpersonen zonder bijkomende bijwerkingen ten opzichte van de therapeutische doses van 0,5 mg.
Er is geen specifiek antidotum voor dutasteride. Daarom moet, in geval van vermoede overdosering, zo nodig een symptomatische en ondersteunende behandeling worden gegeven, waarbij rekening moet worden gehouden met de lange halfwaardetijd van dutasteride.
CONTRA-INDICATIES
AVODART 0,5 mg is gecontra-indiceerd voor gebruik bij:

- Zwangerschap. Het gebruik van Dutasteride is gecontra-indiceerd bij vrouwen die zwanger zijn. In reproductie- en ontwikkelingstoxiciteitsstudies bij dieren remde dutasteride de ontwikkeling van de uitwendige genitaliën van de mannelijke foetus. Daarom kan AVODART 0,5 mg schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties ].
- Patiënten met eerder aangetoonde klinisch significante overgevoeligheid (bijv. ernstige huidreacties, angio-oedeem) voor AVODART of andere 5-alfa-reductaseremmers (zie ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Dutasteride remt de omzetting van testosteron in DHT. DHT is het androgeen dat primair verantwoordelijk is voor de initiële ontwikkeling en daaropvolgende vergroting van de prostaatklier. Testosteron wordt omgezet in DHT door het enzym 5 alfa-reductase, dat bestaat als 2 isovormen, type 1 en type 2. Het type 2 iso-enzym is voornamelijk actief in de voortplantingsweefsels, terwijl het type 1 iso-enzym ook verantwoordelijk is voor de omzetting van testosteron in de huid en lever.
Dutasteride is een competitieve en specifieke remmer van zowel type 1 als type 2 5 alfa-reductase iso-enzymen, waarmee het een stabiel enzymcomplex vormt. Dissociatie van dit complex is geëvalueerd onder in vitro en in vivo omstandigheden en is extreem traag. Dutasteride bindt niet aan de humane androgeenreceptor.
farmacodynamiek
Effect op 5 alfa-dihydrotestosteron en testosteron
Het maximale effect van dagelijkse doses dutasteride op de verlaging van DHT is dosisafhankelijk en wordt binnen 1 tot 2 weken waargenomen. Na 1 en 2 weken dagelijkse dosering met 0,5 mg dutasteride waren de mediane serum-DHT-concentraties met respectievelijk 85% en 90% verlaagd. Bij patiënten met BPH die gedurende 4 jaar met 0,5 mg/dag dutasteride werden behandeld, was de mediane afname van serum-DHT 94% na 1 jaar, 93% na 2 jaar en 95% na zowel 3 als 4 jaar. De mediane toename van serumtestosteron was 19% na zowel 1 als 2 jaar, 26% na 3 jaar en 22% na 4 jaar, maar de gemiddelde en mediane niveaus bleven binnen het fysiologische bereik.
Bij patiënten met BPH die werden behandeld met 5 mg/dag dutasteride of placebo gedurende maximaal 12 weken voorafgaand aan transurethrale resectie van de prostaat, waren de gemiddelde DHT-concentraties in prostaatweefsel significant lager in de dutasteridegroep vergeleken met placebo (784 en 5.793 pg/g respectievelijk P
Volwassen mannen met genetisch overgeërfde type 2 5 alfa-reductasedeficiëntie hebben ook verlaagde DHT-spiegels. Deze mannen met 5 alfa-reductasedeficiëntie hebben hun hele leven een kleine prostaatklier en ontwikkelen geen BPH. Behalve de bijbehorende urogenitale defecten die bij de geboorte aanwezig waren, zijn bij deze personen geen andere klinische afwijkingen waargenomen die verband houden met 5-alfa-reductasedeficiëntie.
Effecten op andere hormonen
Bij gezonde vrijwilligers resulteerde 52 weken behandeling met dutasteride 0,5 mg/dag (n = 26) in geen klinisch significante verandering in vergelijking met placebo (n = 23) in geslachtshormoonbindend globuline, estradiol, luteïniserend hormoon, follikelstimulerend hormoon, thyroxine (vrij T4) en dehydroepiandrosteron. Statistisch significante, voor baseline gecorrigeerde gemiddelde stijgingen in vergelijking met placebo werden waargenomen voor totaal testosteron na 8 weken (97,1 ng/dl, p
Andere effecten
Plasma lipidenpaneel en botmineraaldichtheid werden geëvalueerd na 52 weken dutasteride 0,5 mg eenmaal daags bij gezonde vrijwilligers. Er was geen verandering in de botmineraaldichtheid zoals gemeten met dual energy röntgenabsorptiometrie in vergelijking met placebo of baseline. Bovendien werd het plasmalipidenprofiel (dwz totaal cholesterol, lipoproteïnen met lage dichtheid, lipoproteïnen met hoge dichtheid, triglyceriden) niet beïnvloed door dutasteride. Er werden geen klinisch significante veranderingen waargenomen in de respons van het bijnierhormoon op stimulatie van adrenocorticotroop hormoon (ACTH) in een subgroep (n=13) van de 1-jarige studie met gezonde vrijwilligers.
Farmacokinetiek
Absorptie
Na toediening van een enkelvoudige dosis van 0,5 mg van een zachte gelatinecapsule, treedt de tijd tot piekserumconcentraties (Tmax) van dutasteride binnen 2 tot 3 uur op. De absolute biologische beschikbaarheid bij 5 gezonde proefpersonen is ongeveer 60% (bereik: 40% tot 94%). Wanneer het geneesmiddel met voedsel werd toegediend, werden de maximale serumconcentraties met 10% tot 15% verlaagd. Deze vermindering is van geen klinische betekenis.
Verdeling
Farmacokinetische gegevens na enkelvoudige en herhaalde orale doses laten zien dat dutasteride een groot distributievolume heeft (300 tot 500 l). Dutasteride is sterk gebonden aan plasma-albumine (99,0%) en alfa-1-zuurglycoproteïne (96,6%).
In een onderzoek met gezonde proefpersonen (n = 26) die dutasteride 0,5 mg/dag gedurende 12 maanden kregen, waren de dutasteride-concentraties in het sperma gemiddeld 3,4 ng/ml (bereik: 0,4 tot 14 ng/ml) na 12 maanden en bereikten, vergelijkbaar met serum, een stabiel -staat concentraties op 6 maanden. Gemiddeld werd na 12 maanden 11,5% van de serumdutasterideconcentraties verdeeld in sperma.
Metabolisme en eliminatie
Dutasteride wordt uitgebreid gemetaboliseerd bij de mens. In vitro-onderzoeken hebben aangetoond dat dutasteride wordt gemetaboliseerd door de iso-enzymen CYP3A4 en CYP3A5. Beide iso-enzymen produceerden de 4'-hydroxydutasteride, 6-hydroxydutasteride en de 6,4'-dihydroxydutasteride metabolieten. Bovendien werd de 15-hydroxydutasteride-metaboliet gevormd door CYP3A4. Dutasteride wordt in vitro niet gemetaboliseerd door humane cytochroom P450-iso-enzymen CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 en CYP2E1. In humaan serum na dosering tot steady-state, onveranderd dutasteride, 3 belangrijke metabolieten (4'-hydroxydutasteride, 1,2-dihydrodutasteride en 6-hydroxydutasteride), en 2 minder belangrijke metabolieten (6,4'-dihydroxydutasteride en 15 -hydroxydutasteride), zoals beoordeeld door middel van massaspectrometrische respons, zijn gedetecteerd. De absolute stereochemie van de hydroxyl-addities op de 6- en 15-posities is niet bekend. In vitro zijn de 4'-hydroxydutasteride- en 1,2-dihydrodutasteride-metabolieten veel minder krachtig dan dutasteride tegen beide isovormen van humaan 5-alfa-reductase. De activiteit van 6β-hydroxydutasteride is vergelijkbaar met die van dutasteride.
Dutasteride en zijn metabolieten werden voornamelijk via de feces uitgescheiden. Als percentage van de dosis was er ongeveer 5% onveranderd dutasteride (~1% tot ~15%) en 40% als dutasteride-gerelateerde metabolieten (~2% tot ~90%). In de urine werden slechts sporen van onveranderd dutasteride gevonden (
De terminale eliminatiehalfwaardetijd van dutasteride is ongeveer 5 weken bij steady state. De gemiddelde serumdutasterideconcentratie in steady-state was 40 ng/ml na 0,5 mg/dag gedurende 1 jaar. Na dagelijkse dosering bereiken de serumconcentraties van dutasteride na 1 maand 65% van de steady-state-concentratie en na 3 maanden ongeveer 90%. Vanwege de lange halfwaardetijd van dutasteride blijven serumconcentraties detecteerbaar (hoger dan 0,1 ng/ml) tot 4 tot 6 maanden na stopzetting van de behandeling.
Specifieke populaties
Pediatrische patiënten
De farmacokinetiek van dutasteride is niet onderzocht bij proefpersonen jonger dan 18 jaar.
Geriatrische patiënten
Bij ouderen is geen dosisaanpassing nodig. De farmacokinetiek en farmacodynamiek van dutasteride werden geëvalueerd bij 36 gezonde mannelijke proefpersonen tussen 24 en 87 jaar na toediening van een enkelvoudige dosis dutasteride van 5 mg. In dit onderzoek met een enkelvoudige dosis nam de halfwaardetijd van dutasteride toe met de leeftijd (ongeveer 170 uur bij mannen van 20 tot 49 jaar, ongeveer 260 uur bij mannen van 50 tot 69 jaar en ongeveer 300 uur bij mannen ouder dan 70 jaar). Van de 2.167 mannen die in de 3 centrale onderzoeken met dutasteride werden behandeld, was 60% 65 jaar en ouder en 15% 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze patiënten en jongere patiënten.
Mannelijke en vrouwelijke patiënten
AVODART is gecontra-indiceerd tijdens de zwangerschap en is niet geïndiceerd voor gebruik bij vrouwen [zie: CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. De farmacokinetiek van dutasteride bij vrouwen is niet onderzocht.
Raciale en etnische groepen
Het effect van ras op de farmacokinetiek van dutasteride is niet onderzocht.
Patiënten met nierinsufficiëntie
Het effect van nierinsufficiëntie op de farmacokinetiek van dutasteride is niet onderzocht. Minder dan 0,1% van een steady-state dosis van 0,5 mg dutasteride wordt echter teruggevonden in de menselijke urine, dus er wordt geen dosisaanpassing verwacht voor patiënten met nierinsufficiëntie.
Patiënten met leverinsufficiëntie
Het effect van leverinsufficiëntie op de farmacokinetiek van dutasteride is niet onderzocht. Omdat dutasteride uitgebreid wordt gemetaboliseerd, kan de blootstelling hoger zijn bij patiënten met een leverfunctiestoornis.
Geneesmiddelinteractiestudies
Cytochroom P450-remmers
Er zijn geen klinische onderzoeken naar geneesmiddelinteracties uitgevoerd om de impact van CYP3A-enzymremmers op de farmacokinetiek van dutasteride te evalueren. Op basis van in-vitrogegevens kunnen de bloedconcentraties van dutasteride echter stijgen in aanwezigheid van remmers van CYP3A4/5, zoals ritonavir, ketoconazol, verapamil, diltiazem, cimetidine, troleandomycine en ciprofloxacine.
Dutasteride remt niet het in vitro metabolisme van modelsubstraten voor de belangrijkste humane cytochroom P450-iso-enzymen (CYP1A2, CYP2C9, CYP2C19, CYP2D6 en CYP3A4) bij een concentratie van 1.000 ng/ml, 25 keer hoger dan de steady-state serumconcentraties bij mensen .
Alfa-adrenerge antagonisten
In een single-sequence, cross-over studie bij gezonde vrijwilligers had de toediening van tamsulosine of terazosine in combinatie met AVODART geen effect op de steady-state farmacokinetiek van een van beide alfa-adrenerge antagonisten. Hoewel het effect van toediening van tamsulosine of terazosine op de farmacokinetische parameters van dutasteride niet werd geëvalueerd, was de procentuele verandering in DHT-concentraties vergelijkbaar voor AVODART 0,5 mg alleen vergeleken met de combinatiebehandeling.
Calciumkanaalantagonisten
In een populatiefarmacokinetische analyse werd een afname van de klaring van dutasteride waargenomen bij gelijktijdige toediening met de CYP3A4-remmers verapamil (-37%, n = 6) en diltiazem (-44%, n = 5). Daarentegen werd geen afname van de klaring gezien wanneer amlodipine, een andere calciumantagonist die geen CYP3A4-remmer is, gelijktijdig werd toegediend met dutasteride (+7%, n = 4).
De afname van de klaring en de daaropvolgende toename van de blootstelling aan dutasteride in aanwezigheid van verapamil en diltiazem wordt niet als klinisch significant beschouwd. Er wordt geen dosisaanpassing aanbevolen.
cholestyramine
Toediening van een enkele dosis van 5 mg AVODART 0,5 mg, 1 uur later gevolgd door 12 g colestyramine, had geen invloed op de relatieve biologische beschikbaarheid van dutasteride bij 12 normale vrijwilligers.
Digoxine
In een onderzoek met 20 gezonde vrijwilligers veranderde AVODART 0,5 mg de steady-state farmacokinetiek van digoxine niet bij gelijktijdige toediening in een dosis van 0,5 mg/dag gedurende 3 weken.
Warfarine
In een onderzoek met 23 gezonde vrijwilligers veranderde een behandeling van 3 weken met AVODART 0,5 mg/dag de steady-state farmacokinetiek van de S- of R-warfarine-isomeren niet of veranderde het effect van warfarine op de protrombinetijd bij toediening met warfarine.
Andere gelijktijdige therapie
Hoewel er geen specifieke interactieonderzoeken met andere verbindingen zijn uitgevoerd, gebruikten ongeveer 90% van de proefpersonen in de 3 gerandomiseerde, dubbelblinde, placebogecontroleerde veiligheids- en werkzaamheidsonderzoeken die AVODART kregen gelijktijdig andere medicijnen. Er konden geen klinisch significante nadelige interacties worden toegeschreven aan de combinatie van AVODART en gelijktijdige therapie wanneer AVODART gelijktijdig werd toegediend met antihyperlipidemics, angiotensine-converting enzyme (ACE)-remmers, bèta-adrenerge blokkers, calciumkanaalblokkers, corticosteroïden, diuretica, niet-steroïde anti- -inflammatoire geneesmiddelen (NSAID's), fosfodiësterase Type V-remmers en chinolon-antibiotica.
Dierlijke toxicologie en/of farmacologie
Toxicologische studies van het centrale zenuwstelsel
Bij ratten en honden leidde herhaalde orale toediening van dutasteride ertoe dat sommige dieren tekenen vertoonden van niet-specifieke, reversibele, centraal gemedieerde toxiciteit zonder geassocieerde histopathologische veranderingen bij blootstellingen die respectievelijk 425 en 315 maal hoger waren dan de verwachte klinische blootstelling (van het oorspronkelijke geneesmiddel). .
Konijn dermale absorptie
In een dermaal farmacokinetisch onderzoek bij konijnen resulteerde de dermale absorptie van dutasteride in CAPMUL (glyceryloleaat) bij konijnen in serumconcentraties van 2,7 tot 40,5 mcg/u/ml voor doses van respectievelijk 1 tot 20 mg/ml, of 56% tot 100% van toegepaste dutasteride om te worden geabsorbeerd onder verstopte en langdurige omstandigheden. AVODART zachte gelatinecapsules die oraal worden toegediend, bevatten 0,5 mg dutasteride opgelost in een mengsel van mono-diglyceriden van capryl/caprinezuur en gebutyleerd hydroxytolueen. Dutasteride in water werd minimaal geabsorbeerd bij konijnen (2.000 mg/kg).
Klinische studies
Monotherapie
AVODART 0,5 mg/dag (n = 2.167) of placebo (n = 2.158) werd geëvalueerd bij mannelijke proefpersonen met BPH in drie 2 jaar durende, multicenter, placebogecontroleerde, dubbelblinde onderzoeken, elk met 2 jaar open-label verlengingen ( n = 2.340). Meer dan 90% van de proefpopulatie was blank. De proefpersonen waren ten minste 50 jaar oud met een serum-PSA ≥1,5 ng/ml en
Effect op symptoomscores
Symptomen werden gekwantificeerd met behulp van de AUA-SI, een vragenlijst die urinaire symptomen (onvolledige lediging, frequentie, intermitterend, urgentie, zwakke stroom, overbelasting en nocturie) evalueert door te beoordelen op een schaal van 0 tot 5 voor een totale mogelijke score van 35, met hogere numerieke totale symptoomscores die een grotere ernst van de symptomen vertegenwoordigen. De baseline AUA-SI-score over de 3 onderzoeken was ongeveer 17 eenheden in beide behandelingsgroepen.
Proefpersonen die dutasteride kregen, bereikten een statistisch significante verbetering van de symptomen in vergelijking met placebo tegen maand 3 in 1 onderzoek en tegen maand 12 in de andere 2 hoofdonderzoeken. In maand 12 was de gemiddelde afname van de totale symptoomscores voor AUA-SI in de 3 gepoolde onderzoeken -3,3 eenheden voor dutasteride en -2,0 eenheden voor placebo met een gemiddeld verschil tussen de 2 behandelingsgroepen van -1,3 (spreiding: -1,1). tot -1,5 eenheden in elk van de 3 onderzoeken, P
Deze onderzoeken waren prospectief opgezet om de effecten op de symptomen te evalueren op basis van de grootte van de prostaat bij baseline. Bij mannen met prostaatvolumes ≥40 cc was de gemiddelde afname -3,8 eenheden voor dutasteride en -1,6 eenheden voor placebo, met een gemiddeld verschil tussen de 2 behandelingsgroepen van -2,2 in maand 24. Bij mannen met prostaatvolumes
Afbeelding 1: Verandering in AUA-SI-score t.o.v. baseline (gerandomiseerde, dubbelblinde, placebo-gecontroleerde onderzoeken samengevoegd)
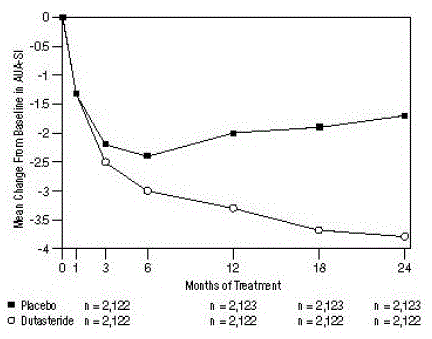
een AUA-SI-score varieert van 0 tot 35.
Effect op acute urineretentie en de noodzaak van BPH-gerelateerde chirurgie
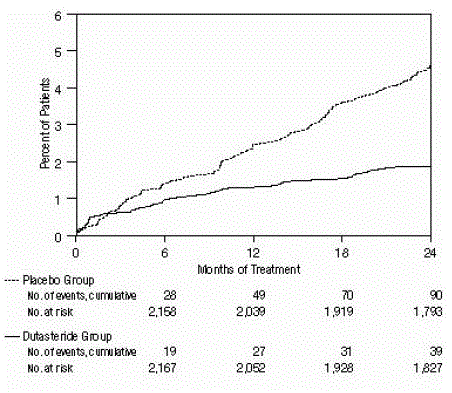
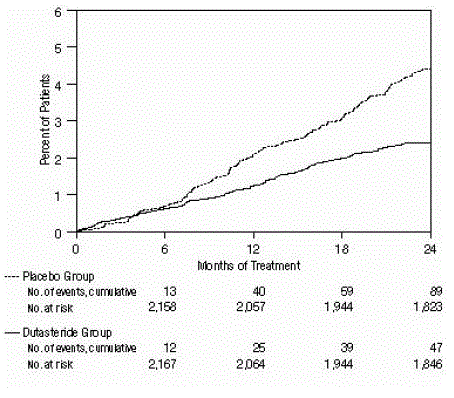
De werkzaamheid werd ook beoordeeld na 2 jaar behandeling door de incidentie van AUR waarvoor katheterisatie en BPH-gerelateerde urologische chirurgische ingreep nodig waren. Vergeleken met placebo was AVODART geassocieerd met een statistisch significant lagere incidentie van AUR (1,8% voor AVODART versus 4,2% voor placebo, P
Figuur 2: Percentage proefpersonen dat acute urineretentie ontwikkelt gedurende een periode van 24 maanden (gerandomiseerde, dubbelblinde, placebo-gecontroleerde onderzoeken samengevoegd)
Figuur 3: Percentage proefpersonen dat een operatie heeft ondergaan voor goedaardige prostaathyperplasie gedurende een periode van 24 maanden (gerandomiseerde, dubbelblinde, placebo-gecontroleerde onderzoeken samengevoegd)
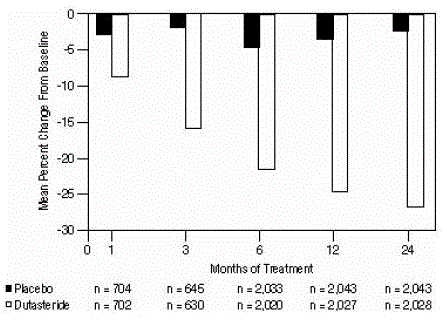
Effect op prostaatvolume
Een prostaatvolume van ten minste 30 cc gemeten met transrectale echografie was vereist voor deelname aan het onderzoek. Het gemiddelde prostaatvolume bij aanvang van het onderzoek was ongeveer 54 cc.
Statistisch significante verschillen (AVODART 0,5 mg versus placebo) werden opgemerkt bij de vroegste prostaatvolumemeting na de behandeling in elk onderzoek (maand 1, maand 3 of maand 6) en duurden voort tot maand 24. Op maand 12 was de gemiddelde procentuele verandering in prostaatvolume over de 3 gepoolde onderzoeken was -24,7% voor dutasteride en -3,4% voor placebo; het gemiddelde verschil (dutasteride minus placebo) was -21,3% (spreiding: -21,0% tot -21,6% in elk van de 3 onderzoeken, p
Figuur 4: Prostaatvolume procentuele verandering ten opzichte van baseline (gerandomiseerde, dubbelblinde, placebo-gecontroleerde onderzoeken samengevoegd)
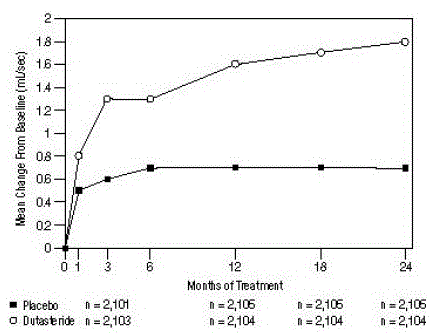
Effect op maximale urinestroom
Een gemiddelde piekurinestroomsnelheid (Qmax) van ≤15 ml/sec was vereist voor deelname aan het onderzoek. Qmax was ongeveer 10 ml/sec bij baseline over de 3 hoofdonderzoeken.
De verschillen tussen de 2 groepen waren statistisch significant vanaf de uitgangswaarde op maand 3 in alle 3 onderzoeken en hielden aan tot maand 12. Op maand 12 was de gemiddelde toename in Qmax over de 3 samengevoegde onderzoeken 1,6 ml/sec voor AVODART 0,5 mg en 0,7 ml /sec voor placebo; het gemiddelde verschil (dutasteride minus placebo) was 0,8 ml/sec (bereik: 0,7 tot 1,0 ml/sec in elk van de 3 onderzoeken, P
Afbeelding 5: Qmax-verandering t.o.v. baseline (gerandomiseerde, dubbelblinde, placebo-gecontroleerde onderzoeken gepoold)
Samenvatting van klinische onderzoeken
Gegevens uit 3 grote, goed gecontroleerde werkzaamheidsonderzoeken tonen aan dat behandeling met AVODART (0,5 mg eenmaal daags) het risico op zowel AUR als BPH-gerelateerde chirurgische ingrepen vermindert in vergelijking met placebo, BPH-gerelateerde symptomen verbetert, het prostaatvolume verlaagt en de maximale urinestroomsnelheden. Deze gegevens suggereren dat AVODART 0,5 mg het ziekteproces van BPH stopt bij mannen met een vergrote prostaat.
Combinatie met alfablokkertherapie (CombAT)
De werkzaamheid van combinatietherapie (AVODART 0,5 mg/dag plus tamsulosine 0,4 mg/dag, n = 1.610) werd vergeleken met AVODART 0,5 mg alleen (n = 1.623) of tamsulosine alleen (n = 1.611) in een 4 jaar durend multicenter, gerandomiseerd , dubbelblind onderzoek. De criteria voor deelname aan het onderzoek waren vergelijkbaar met de dubbelblinde, placebogecontroleerde werkzaamheidsonderzoeken met monotherapie die zijn beschreven in rubriek 14.1. Achtentachtig procent (88%) van de ingeschreven onderzoekspopulatie was blank. Ongeveer 52% van de proefpersonen was eerder blootgesteld aan 5-alfa-reductase-remmer of alfa-adrenerge antagonistische behandeling. Van de 4.844 proefpersonen die willekeurig waren toegewezen voor behandeling, voltooiden 69% van de proefpersonen in de combinatiegroep, 67% in de groep die AVODART 0,5 mg kreeg en 61% in de tamsulosinegroep een dubbelblinde behandeling van 4 jaar.
Effect op symptoomscore
Symptomen werden gekwantificeerd met behulp van de eerste 7 vragen van de International Prostate Symptom Score (IPSS) (identiek aan de AUA-SI). De baselinescore was ongeveer 16,4 eenheden voor elke behandelingsgroep. Combinatietherapie was statistisch superieur aan elk van de monotherapiebehandelingen in afnemende symptoomscore in maand 24, het primaire tijdstip voor dit eindpunt. In maand 24 waren de gemiddelde veranderingen ten opzichte van baseline (±SD) in de totale symptoomscores van IPSS -6,2 (±7,14) voor combinatie, -4,9 (±6,81) voor AVODART en -4,3 (±7,01) voor tamsulosine, met een gemiddeld verschil tussen combinatie en AVODART 0,5 mg van -1,3 eenheden (P
Afbeelding 6: Internationale prostaatsymptoomscore Verandering van baseline over een periode van 48 maanden (gerandomiseerde, dubbelblinde, parallelle groepstudie [CombAT-studie])
![International Prostate Symptom Score Change from Baseline over a 48Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/a7d67731ff7779ceebeae06afda359e7.jpg)
Effect op acute urineretentie of de noodzaak van BPH-gerelateerde chirurgie
Na 4 jaar behandeling had combinatietherapie met AVODART 0,5 mg en tamsulosine geen voordeel ten opzichte van monotherapie met AVODART bij het verminderen van de incidentie van AUR of BPH-gerelateerde chirurgie.
Effect op maximale urinestroom
De baseline Qmax was ongeveer 10,7 ml/sec voor elke behandelingsgroep. Combinatietherapie was statistisch superieur aan elk van de monotherapiebehandelingen bij het verhogen van Qmax in maand 24, het primaire tijdstip voor dit eindpunt. In maand 24 waren de gemiddelde stijgingen vanaf baseline (±SD) in Qmax 2,4 (±5,26) ml/sec voor combinatie, 1,9 (±5,10) ml/sec voor AVODART 0,5 mg en 0,9 (± 4,57) ml/sec voor tamsulosine, met een gemiddeld verschil tussen combinatie en AVODART van 0,5 ml/sec (P = 0,003; [95% BI: 0,17; 0,84]), en tussen combinatie en tamsulosine van 1,5 ml/sec (P
De aanvullende verbetering in Qmax van combinatietherapie ten opzichte van monotherapie met AVODART 0,5 mg was niet langer statistisch significant in maand 48.
Afbeelding 7: Qmax-verandering vanaf baseline over een periode van 24 maanden (gerandomiseerde, dubbelblinde proef met parallelle groepen [CombAT-proef])
![Qmax Change from Baseline over a 24-Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/c121e3757b083409368e05d34b33da53.jpg)
Effect op prostaatvolume
Het gemiddelde prostaatvolume bij aanvang van het onderzoek was ongeveer 55 cc. Op maand 24, het primaire tijdstip voor dit eindpunt, waren de gemiddelde procentuele veranderingen vanaf baseline (±SD) in prostaatvolume -26,9% (±22,57) voor combinatietherapie, -28,0% (±24,88) voor AVODART 0,5 mg en 0% (±31,14) voor tamsulosine, met een gemiddeld verschil tussen combinatie en AVODART 0,5 mg van 1,1% (P = NS; [95% BI: -0,6, 2,8]), en tussen combinatie en tamsulosine van -26,9% (P
PATIËNT INFORMATIE
AVODART (av o dart) (dutasteride) capsules
AVODART 0,5 mg is alleen voor gebruik door mannen.
Lees deze patiënteninformatie voordat u AVODART 0,5 mg gaat gebruiken en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of uw behandeling.
Wat is AVODART 0,5 mg?
AVODART 0,5 mg is een receptgeneesmiddel dat dutasteride bevat. AVODART 0,5 mg wordt gebruikt voor de behandeling van de symptomen van goedaardige prostaathyperplasie (BPH) bij mannen met een vergrote prostaat om:
- symptomen verbeteren,
- het risico op acute urineretentie verminderen (een volledige blokkering van de urinestroom),
- het risico op de noodzaak van BPH-gerelateerde chirurgie te verminderen.
Wie mag AVODART NIET gebruiken?
Gebruik AVODART niet als u:
- zwanger bent of zwanger zou kunnen worden. AVODART 0,5 mg kan uw ongeboren baby schaden. Zwangere vrouwen mogen AVODART-capsules niet aanraken. Als een vrouw die zwanger is van een mannelijke baby genoeg AVODART 0,5 mg in haar lichaam krijgt door AVODART in te slikken of aan te raken, kan de mannelijke baby geboren worden met geslachtsorganen die niet normaal zijn. Als een zwangere vrouw of een vrouw die zwanger kan worden, in contact komt met lekkende AVODART 0,5 mg capsules, moet het contactgebied onmiddellijk worden gewassen met water en zeep.
- een kind of een tiener.
- allergisch zijn voor dutasteride of voor één van de bestanddelen van AVODART. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in AVODART.
- allergisch voor andere 5 alfa-reductaseremmers, bijvoorbeeld PROSCAR (finasteride)®-tabletten.
Wat moet ik mijn zorgverlener vertellen voordat ik AVODART 0,5 mg inneem?
Vertel uw zorgverlener voordat u AVODART 0,5 mg inneemt als u:
- leverproblemen hebben
Vertel uw zorgverlener over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. AVODART en andere geneesmiddelen kunnen elkaar beïnvloeden en bijwerkingen veroorzaken. AVODART 0,5 mg kan de werking van andere geneesmiddelen beïnvloeden en andere geneesmiddelen kunnen de werking van AVODART 0,5 mg beïnvloeden.
Weet welke medicijnen u gebruikt. Houd er een lijst van bij om uw zorgverlener en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik AVODART gebruiken?
- Neem eenmaal per dag 1 AVODART-capsule.
- Slik AVODART 0,5 mg capsules heel door. U mag AVODART 0,5 mg capsules niet pletten, erop kauwen of openen omdat de inhoud van de capsule uw lippen, mond of keel kan irriteren.
- U kunt AVODART 0,5 mg met of zonder voedsel innemen.
- Als u een dosis overslaat, mag u deze later op de dag innemen. Haal de vergeten dosis niet in door de volgende dag 2 doses in te nemen.
Wat moet ik vermijden tijdens het gebruik van AVODART 0,5 mg?
- U mag geen bloed doneren tijdens het gebruik van AVODART of gedurende 6 maanden nadat u met AVODART bent gestopt. Dit is belangrijk om te voorkomen dat zwangere vrouwen AVODART krijgen via bloedtransfusies.
Wat zijn de mogelijke bijwerkingen van AVODART?
AVODART kan ernstige bijwerkingen veroorzaken, waaronder:
- Zeldzame en ernstige allergische reacties, waaronder:
- zwelling van uw gezicht, tong of keel
- ernstige huidreacties, zoals vervellen van de huid
Roep meteen medische hulp in als u last heeft van deze ernstige allergische reacties.
- Grotere kans op een ernstiger vorm van prostaatkanker.
De meest voorkomende bijwerkingen van AVODART zijn:
- moeite met het krijgen of behouden van een erectie (impotentie)*
- een afname van de zin in seks (libido)*
- ejaculatie problemen*
- vergrote of pijnlijke borsten. Als u borstknobbels of tepelafscheiding opmerkt, moet u contact opnemen met uw zorgverlener.
*Sommige van deze gebeurtenissen kunnen aanhouden nadat u bent gestopt met het innemen van AVODART.
Een depressieve stemming is gemeld bij patiënten die AVODART kregen.
Van AVODART 0,5 mg is aangetoond dat het het aantal zaadcellen, het spermavolume en de beweging van het sperma vermindert. Het effect van AVODART 0,5 mg op de mannelijke vruchtbaarheid is echter niet bekend.
Prostaatspecifieke antigeen (PSA) test: Uw zorgverlener kan u controleren op andere prostaatproblemen, waaronder prostaatkanker, voordat u begint en terwijl u AVODART gebruikt. Een bloedtest genaamd PSA (prostaat-specifiek antigeen) wordt soms gebruikt om te zien of u mogelijk prostaatkanker heeft. AVODART zal de hoeveelheid PSA die in uw bloed wordt gemeten, verlagen. Uw zorgverlener is op de hoogte van dit effect en kan PSA nog steeds gebruiken om te zien of u mogelijk prostaatkanker heeft. Verhogingen van uw PSA-waarden tijdens behandeling met AVODART (zelfs als de PSA-waarden binnen het normale bereik liggen) moeten door uw zorgverlener worden beoordeeld.
Vertel het uw zorgverlener als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van AVODART. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik AVODART 0,5 mg bewaren?
- Bewaar AVODART 0,5 mg capsules bij kamertemperatuur (59 ° F tot 86 ° F of 15 ° C tot 30 ° C).
- AVODART 0,5 mg capsules kunnen vervormen en/of verkleuren als ze bij hoge temperaturen worden bewaard.
- Gebruik AVODART 0,5 mg niet als uw capsules vervormd, verkleurd of lekkend zijn.
- Gooi medicijnen die niet meer nodig zijn, veilig weg.
Bewaar AVODART 0,5 mg en alle geneesmiddelen buiten het bereik van kinderen.
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan die in een patiëntenbijsluiter worden vermeld. Gebruik AVODART 0,5 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef AVODART niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze patiëntenbijsluiter vat de belangrijkste informatie over AVODART samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw apotheker of zorgverlener om informatie vragen over AVODART 0,5 mg die is geschreven voor gezondheidswerkers.
Ga voor meer informatie naar www.AVODART.com of bel 1-888-825-5249.
Wat zijn de ingrediënten in AVODART 0,5 mg?
Actief ingrediënt: dutasteride.
Inactieve ingredienten : gebutyleerd hydroxytolueen, ijzeroxide (geel), gelatine (van gecertificeerde BSE-vrije runderbronnen), glycerine, mono-diglyceriden van capryl/caprinezuur, titaandioxide en eetbare rode inkt.
Hoe werkt AVODART?
Prostaatgroei wordt veroorzaakt door een hormoon in het bloed dat dihydrotestosteron (DHT) wordt genoemd. AVODART verlaagt de DHT-productie in het lichaam, wat bij de meeste mannen leidt tot krimp van de vergrote prostaat. Hoewel sommige mannen minder problemen en symptomen hebben na 3 maanden behandeling met AVODART, is een behandelingsperiode van ten minste 6 maanden meestal nodig om te zien of AVODART 0,5 mg voor u werkt.
Deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration.
