Xalatan 2.5ml Latanoprost Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
XALATAN® (latanoprost) Oftalmische oplossing
OMSCHRIJVING
Latanoprost is een prostaglandine F2α-analoog. De chemische naam is isopropyl-(Z)-7[(1R,2R,3R,5S)3,5dihydroxy-2-[(3R)-3-hydroxy-5-fenylpentyl]cyclopentyl]-5-heptenoaat. De molecuulformule is C26H40O5 en de chemische structuur is:
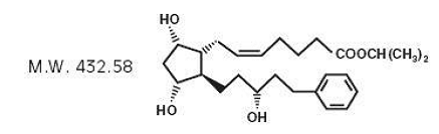
Latanoprost is een kleurloze tot lichtgele olie die zeer goed oplosbaar is in acetonitril en goed oplosbaar is in aceton, ethanol, ethylacetaat, isopropanol, methanol en octanol. Het is praktisch onoplosbaar in water.
XALATAN (latanoprost oftalmische oplossing) 0, 005% wordt geleverd als een steriele, isotone, gebufferde waterige oplossing van latanoprost met een pH van ongeveer 6,7 en een osmolaliteit van ongeveer 267 mOsmol / kg. Elke ml XALATAN bevat 50 mcg latanoprost. Benzalkoniumchloride, 0,02% wordt toegevoegd als conserveermiddel. De inactieve ingrediënten zijn: natriumchloride, natriumdiwaterstoffosfaatmonohydraat, watervrij dinatriumwaterstoffosfaat en water voor injectie. Eén druppel bevat ongeveer 1,5 mcg latanoprost.
INDICATIES
XALATAN 2,5 ml is geïndiceerd voor de verlaging van verhoogde intraoculaire druk bij patiënten met openhoekglaucoom of oculaire hypertensie.
DOSERING EN ADMINISTRATIE
De aanbevolen dosering is eenmaal daags 's avonds één druppel in het (de) aangedane oog (ogen). Als een dosis is overgeslagen, moet de behandeling zoals gewoonlijk worden voortgezet met de volgende dosis.
De dosering van XALATAN mag niet hoger zijn dan eenmaal daags; het gecombineerde gebruik van twee of meer prostaglandinen of prostaglandine-analogen waaronder XALATAN 2,5 ml wordt niet aanbevolen. Er is aangetoond dat toediening van deze prostaglandinegeneesmiddelen meer dan eenmaal per dag het intraoculaire drukverlagende effect (IOD) kan verminderen of paradoxale verhogingen van de IOD kan veroorzaken.
Verlaging van de IOD begint ongeveer 3 tot 4 uur na toediening en het maximale effect wordt bereikt na 8 tot 12 uur.
XALATAN kan gelijktijdig met andere plaatselijke oogheelkundige geneesmiddelen worden gebruikt om de IOD te verlagen. Als er meer dan één actueel oogheelkundig geneesmiddel wordt gebruikt, moeten de geneesmiddelen met een tussenpoos van ten minste vijf (5) minuten worden toegediend. Contactlenzen moeten worden verwijderd voordat XALATAN 2,5 ml wordt toegediend en kunnen 15 minuten na toediening opnieuw worden ingebracht
HOE GELEVERD
Doseringsvormen en sterke punten
Steriele oftalmische oplossing met 50 mcg/ml latanoprost.
Opslag en behandeling
XALATAN is een heldere, isotone, gebufferde, geconserveerde kleurloze oplossing van latanoprost 0,005% (50 mcg/ml). Het wordt geleverd als een oplossing van 2,5 ml in een doorzichtige fles van 5 ml van polyethyleen met lage dichtheid met een doorzichtige druppelaar van polyethyleen, een turquoise schroefdop van polyethyleen met hoge dichtheid en een verzegelde doorzichtige dop van polyethyleen met lage dichtheid.
2,5 ml vulling, 0,005% (50 mcg/ml): Verpakking van 1 fles: NDC 0013-8303-04 2,5 ml vulling, 0,005% (50 mcg/ml): Multiverpakking van 3 flessen: NDC 0013-8303-01
Opslag
Bescherm tegen licht. Bewaar ongeopende fles(sen) onder koeling bij 2 ° tot 8 ° C (36 ° tot 46 ° F). Tijdens verzending naar de patiënt mag de fles gedurende een periode van niet meer dan 8 dagen bij temperaturen tot 40°C (104°F) worden bewaard. Zodra een fles is geopend voor gebruik, kan deze gedurende 6 weken bij kamertemperatuur tot 25°C (77°F) worden bewaard.
Gedistribueerd door: Pharmacia & Upjohn Co., Division of Pfizer Inc., NY, NY 10017. Pfizer Manufacturing Belgium NV Puurs, België. Herzien: n.v.t
BIJWERKINGEN
De volgende bijwerkingen zijn gemeld tijdens postmarketingervaring en worden in meer detail besproken in andere rubrieken van het etiket:
- Irispigmentatie verandert [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ooglid huid donkerder [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Wimperveranderingen (toegenomen lengte, dikte, pigmentatie en aantal wimpers) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Intraoculaire ontsteking (iritis/uveïtis) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Macula-oedeem, inclusief cystoïd macula-oedeem [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
XALATAN 2,5 ml werd onderzocht in drie multicenter, gerandomiseerde, gecontroleerde klinische onderzoeken. Patiënten kregen 50 mcg/ml XALATAN eenmaal daags of 5 mg/ml actieve comparator (timolol) tweemaal daags. De onderzochte patiëntenpopulatie had een gemiddelde leeftijd van 65±10 jaar. Zeven procent van de patiënten trok zich terug vóór het eindpunt van 6 maanden.
Bij minder dan 1% van de patiënten die met XALATAN 2,5 ml werden behandeld, moest de behandeling worden gestaakt vanwege intolerantie voor conjunctivale hyperemie.
De oculaire gebeurtenis/tekenen en symptomen van blefaritis zijn geïdentificeerd als "vaak waargenomen" door analyse van klinische onderzoeksgegevens.
Postmarketingervaring
De volgende reacties zijn vastgesteld tijdens postmarketinggebruik van XALATAN in de klinische praktijk. Omdat ze vrijwillig worden gerapporteerd door een populatie van onbekende omvang, is het niet altijd mogelijk om een betrouwbare schatting van hun frequentie te maken of een oorzakelijk verband met blootstelling aan drugs vast te stellen. De reacties, die voor opname zijn gekozen vanwege hun ernst, frequentie van melding, mogelijk causaal verband met XALATAN 2,5 ml, of een combinatie van deze factoren, zijn onder meer:
Zenuwstelselaandoeningen: Duizeligheid; hoofdpijn; toxische epidermale necrolyse
Oogaandoeningen: Wimper- en vellushaarveranderingen van het ooglid (toegenomen lengte, dikte, pigmentatie en aantal wimpers); keratitis; cornea-oedeem en erosies; intraoculaire ontsteking (iritis/uveïtis); macula-oedeem, inclusief cystoïd macula-oedeem; trichiasis; periorbitale en ooglidveranderingen resulterend in verdieping van de ooglidsulcus; iris cyste; verdonkering van de huid van het ooglid; gelokaliseerde huidreactie op de oogleden; conjunctivitis; pseudopemfigoïd van de oculaire conjunctiva
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: Astma en verergering van astma; kortademigheid
Huid- en onderhuidaandoeningen: pruritus
Infecties en parasitaire aandoeningen: Herpes keratitis
Hartaandoeningen: Angina; hartkloppingen; angina instabiel
Algemene aandoeningen en toedieningsplaatsvoorwaarden: pijn op de borst
DRUG-INTERACTIES
In vitro-onderzoeken hebben aangetoond dat precipitatie optreedt wanneer oogdruppels die thimerosal bevatten, worden gemengd met XALATAN. Als dergelijke medicijnen worden gebruikt, moeten ze met een tussenpoos van ten minste vijf (5) minuten worden toegediend.
Het gecombineerde gebruik van twee of meer prostaglandinen of prostaglandine-analogen inclusief XALATAN 2,5 ml wordt niet aanbevolen. Het is aangetoond dat toediening van deze prostaglandinegeneesmiddelen meer dan eenmaal per dag het IOD-verlagende effect kan verminderen of paradoxale verhogingen van de IOD kan veroorzaken.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
pigmentatie
Van XALATAN is gemeld dat het veranderingen in gepigmenteerde weefsels veroorzaakt. De meest frequent gemelde veranderingen zijn toegenomen pigmentatie van de iris, periorbitaal weefsel (ooglid) en wimpers. De pigmentatie zal naar verwachting toenemen zolang latanoprost wordt toegediend.
De pigmentatieverandering is eerder te wijten aan een verhoogd melaninegehalte in de melanocyten dan aan een toename van het aantal melanocyten. Na stopzetting van de behandeling met latanoprost is de pigmentatie van de iris waarschijnlijk permanent, terwijl is gemeld dat pigmentatie van het periorbitale weefsel en wimperveranderingen bij sommige patiënten reversibel zijn. Patiënten die worden behandeld, moeten worden geïnformeerd over de mogelijkheid van verhoogde pigmentatie. Na 5 jaar zijn de effecten van verhoogde pigmentatie niet bekend [zie Klinische studies ].

Iriskleurverandering kan enkele maanden tot jaren niet merkbaar zijn. Doorgaans verspreidt de bruine pigmentatie rond de pupil zich concentrisch naar de periferie van de iris en wordt de hele iris of delen van de iris bruinachtiger. Noch naevi, noch sproeten van de iris lijken te worden beïnvloed door de behandeling. Hoewel de behandeling met XALATAN 2,5 ml kan worden voortgezet bij patiënten die een merkbaar verhoogde irispigmentatie ontwikkelen, moeten deze patiënten regelmatig worden onderzocht [zie PATIËNT INFORMATIE ].
Wimperveranderingen
XALATAN 2,5 ml kan de wimpers en vellushaar in het behandelde oog geleidelijk veranderen; deze veranderingen omvatten een grotere lengte, dikte, pigmentatie, het aantal wimpers of haren en verkeerd gerichte wimpergroei. Wimperveranderingen zijn meestal omkeerbaar na stopzetting van de behandeling [zie PATIËNT INFORMATIE ].
Intraoculaire ontsteking
XALATAN 2,5 ml moet met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van intraoculaire ontsteking (iritis/uveïtis) en mag over het algemeen niet worden gebruikt bij patiënten met actieve intraoculaire ontsteking omdat de ontsteking kan verergeren.
Macula-oedeem
Macula-oedeem, inclusief cystoïd macula-oedeem, is gemeld tijdens behandeling met XALATAN. XALATAN 2,5 ml moet met voorzichtigheid worden gebruikt bij afake patiënten, bij pseudofake patiënten met een gescheurd achterste lenskapsel of bij patiënten met bekende risicofactoren voor macula-oedeem.
Herpetische keratitis
Reactivering van Herpes Simplex keratitis is gemeld tijdens behandeling met XALATAN. XALATAN 2,5 ml moet met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van herpetische keratitis. XALATAN 2,5 ml moet worden vermeden in geval van actieve herpes simplex keratitis omdat de ontsteking kan verergeren.
Bacteriële keratitis
Er zijn meldingen geweest van bacteriële keratitis in verband met het gebruik van flacons met meerdere doses actuele oftalmische producten. Deze containers waren onbedoeld besmet door patiënten die, in de meeste gevallen, een gelijktijdige cornea-aandoening of een verstoring van het oogepitheeloppervlak hadden [zie PATIËNT INFORMATIE ].
Gebruik met contactlenzen
Contactlenzen moeten vóór toediening van XALATAN worden verwijderd en kunnen 15 minuten na toediening opnieuw worden ingebracht.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Latanoprost was niet carcinogeen bij muizen of ratten bij orale toediening in doses tot 170 mcg/kg/dag (ongeveer 2800 maal de aanbevolen maximale dosis voor de mens) gedurende respectievelijk 20 en 24 maanden.
Latanoprost was niet mutageen in bacteriën, in muizenlymfoom of in micronucleustests bij muizen. Chromosoomafwijkingen werden in vitro waargenomen bij menselijke lymfocyten. Aanvullende in vitro en in vivo onderzoeken naar ongeplande DNA-synthese bij ratten waren negatief.
In dierstudies is niet gevonden dat latanoprost enig effect heeft op de mannelijke of vrouwelijke vruchtbaarheid.
Gebruik bij specifieke populaties
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C.
Er zijn reproductieonderzoeken uitgevoerd bij ratten en konijnen. Bij konijnen had een incidentie van 4 van de 16 moederdieren geen levensvatbare foetussen bij een dosis die ongeveer 80 keer de maximale dosis voor de mens was, en de hoogste niet-mbryocidale dosis bij konijnen was ongeveer 15 keer de maximale dosis voor de mens.
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. XALATAN 2,5 ml mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Moeders die borstvoeding geven
Het is niet bekend of dit geneesmiddel of zijn metabolieten in de moedermelk worden uitgescheiden. Omdat veel geneesmiddelen in de moedermelk worden uitgescheiden, is voorzichtigheid geboden wanneer XALATAN 2,5 ml wordt toegediend aan een vrouw die borstvoeding geeft.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Er zijn geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen oudere en jongere patiënten.
OVERDOSERING
Intraveneuze infusie tot 3 mcg/kg bij gezonde vrijwilligers produceerde gemiddelde plasmaconcentraties die 200 keer hoger waren dan tijdens klinische behandeling en er werden geen bijwerkingen waargenomen. Intraveneuze doseringen van 5,5 tot 10 mcg/kg veroorzaakten buikpijn, duizeligheid, vermoeidheid, opvliegers, misselijkheid en zweten. Als overdosering met XALATAN optreedt, dient de behandeling symptomatisch te zijn.
CONTRA-INDICATIES
Bekende overgevoeligheid voor latanoprost, benzalkoniumchloride of enig ander bestanddeel van dit product.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Latanoprost is een prostanoïde-selectieve FP-receptoragonist waarvan wordt aangenomen dat deze de intraoculaire druk (IOP) verlaagt door de uitstroom van kamerwater te vergroten. Studies bij dieren en mensen suggereren dat het belangrijkste werkingsmechanisme een verhoogde uveosclerale uitstroom is. Verhoogde IOD vertegenwoordigt een belangrijke risicofactor voor glaucoomveldverlies. Hoe hoger het IOP-niveau, hoe groter de kans op beschadiging van de oogzenuw en verlies van gezichtsveld.
farmacodynamiek
Verlaging van de IOD bij de mens begint ongeveer 3-4 uur na toediening en het maximale effect wordt bereikt na 8-12 uur. IOP-reductie is minimaal 24 uur aanwezig.
Farmacokinetiek
Absorptie
Latanoprost wordt geabsorbeerd door het hoornvlies waar de isopropylester prodrug wordt gehydrolyseerd tot de zuurvorm om biologisch actief te worden.
Verdeling
Het distributievolume bij mensen is 0,16 ± 0,02 l/kg. Het zuur van latanoprost kan de eerste 4 uur in kamerwater worden gemeten en alleen in het eerste uur na lokale toediening in plasma. Studies bij de mens geven aan dat de piekconcentratie in het kamerwater ongeveer twee uur na plaatselijke toediening wordt bereikt.
Metabolisme
Latanoprost, een isopropylester prodrug, wordt door esterasen in het hoornvlies gehydrolyseerd tot het biologisch actieve zuur. Het actieve zuur van latanoprost dat de systemische circulatie bereikt, wordt voornamelijk door de lever gemetaboliseerd tot de 1,2-dinor- en 1,2,3,4-tetranormetabolieten via vetzuur-β-oxidatie.
uitscheiding
De eliminatie van het zuur van latanoprost uit humaan plasma is snel (t½ = 17 min) na zowel intraveneuze als topische toediening. De systemische klaring is ongeveer 7 ml/min/kg. Na hepatische β-oxidatie worden de metabolieten voornamelijk via de nieren geëlimineerd. Ongeveer 88% en 98% van de toegediende dosis wordt in de urine teruggevonden na respectievelijk topische en intraveneuze toediening.
Klinische studies
Verhoogde baseline IOP
Patiënten met een gemiddelde IOD bij aanvang van 24 - 25 mmHg die gedurende 6 maanden werden behandeld in multicenter, gerandomiseerde, gecontroleerde onderzoeken, vertoonden verlagingen van de IOD van 6 - 8 mmHg. Deze IOD-verlaging met XALATAN 0,005% eenmaal daags gedoseerd was gelijk aan het effect van timolol 0,5% tweemaal daags gedoseerd.
Progressie van verhoogde irispigmentatie
Er werd een 3 jaar durend open-label, prospectief veiligheidsonderzoek met een verlengingsfase van 2 jaar uitgevoerd om de progressie van toegenomen irispigmentatie te evalueren bij continu gebruik van XALATAN eenmaal daags als aanvullende therapie bij 519 patiënten met openhoekglaucoom. De analyse was gebaseerd op de populatie met waargenomen gevallen van de 380 patiënten die doorgingen in de verlengingsfase.
De resultaten toonden aan dat het begin van een merkbare toename van de irispigmentatie optrad binnen het eerste jaar van de behandeling voor de meerderheid van de patiënten die een merkbare toename van de irispigmentatie ontwikkelden. Patiënten bleven gedurende de vijf jaar van het onderzoek tekenen van toenemende irispigmentatie vertonen. Waarneming van verhoogde irispigmentatie had geen invloed op de incidentie, aard of ernst van bijwerkingen (anders dan verhoogde irispigmentatie) die in het onderzoek werden geregistreerd. IOD-reductie was vergelijkbaar, ongeacht de ontwikkeling van verhoogde irispigmentatie tijdens het onderzoek.
PATIËNT INFORMATIE
Potentieel voor pigmentatie
Adviseer patiënten over de mogelijkheid van verhoogde bruine pigmentatie van de iris, die permanent kan zijn. Informeer patiënten over de mogelijkheid dat de huid van de oogleden donkerder wordt, wat omkeerbaar kan zijn na stopzetting van XALATAN (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Potentieel voor wimperveranderingen
Informeer patiënten over de mogelijkheid van wimper- en vellushaarveranderingen in het behandelde oog tijdens de behandeling met XALATAN. Deze veranderingen kunnen resulteren in een verschil tussen de ogen in lengte, dikte, pigmentatie, aantal wimpers of vellusharen en/of richting van wimpergroei. Wimperveranderingen zijn meestal omkeerbaar na stopzetting van de behandeling.
Omgaan met de container
Instrueer patiënten om te voorkomen dat de punt van de dispenser in contact komt met het oog of de omliggende structuren, omdat dit ertoe kan leiden dat de punt besmet raakt met gewone bacteriën waarvan bekend is dat ze ooginfecties veroorzaken. Ernstige schade aan het oog en daaropvolgend verlies van gezichtsvermogen kan het gevolg zijn van het gebruik van verontreinigde oplossingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Wanneer moet u een arts raadplegen?
Adviseer patiënten dat als ze een bijkomende oogaandoening ontwikkelen (bijv. trauma of infectie) of een oogoperatie ondergaan, of oogreacties ontwikkelen, met name conjunctivitis en ooglidreacties, ze onmiddellijk het advies van hun arts moeten inwinnen over het voortgezette gebruik van de meervoudige dosis container.
Gebruik met contactlenzen
Adviseer patiënten dat XALATAN 2,5 ml benzalkoniumchloride bevat, dat door contactlenzen kan worden opgenomen. Contactlenzen moeten worden verwijderd voordat de oplossing wordt toegediend. Lenzen kunnen 15 minuten na toediening van XALATAN opnieuw worden ingebracht.
Gebruik met andere oogheelkundige geneesmiddelen
Als er meer dan één actueel oogheelkundig geneesmiddel wordt gebruikt, moeten de geneesmiddelen met een tussenpoos van ten minste vijf (5) minuten worden toegediend.
