Oogdruppels: Lumigan 3ml Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Lumigan en hoe wordt het gebruikt?
Lumigan 3ml is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van verhoogde intraoculaire druk veroorzaakt door bepaalde vormen van glaucoom en hypotrichose van de wimpers. Lumigan kan alleen of in combinatie met andere medicijnen worden gebruikt.
Lumigan behoort tot een klasse geneesmiddelen die antiglaucoom, prostaglandine-agonisten worden genoemd.
Het is niet bekend of Lumigan veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Lumigan?
Lumigan kan ernstige bijwerkingen veroorzaken, waaronder:
- oog zwelling,
- roodheid van het oog,
- ernstig ongemak in het oog,
- korstvorming of drainage uit het oog,
- visie verandert, en
- rode, gezwollen of jeukende oogleden
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Lumigan zijn:
- roodheid van de ogen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Lumigan. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
LUMIGAN® (bimatoprost oftalmische oplossing) 0, 03% is een synthetisch prostamide-analoog met oculaire hypotensieve activiteit. De chemische naam is (Z)-7-[(1R,2R,3R,5S)-3,5-Dihydroxy-2[(1E,3S)-3-hydroxy-5-fenyl-1-pentenyl]cyclopentyl]- 5-N-ethylheptenamide, en het molecuulgewicht is 415,58. De moleculaire formule is C25H37NO4. De chemische structuur is:
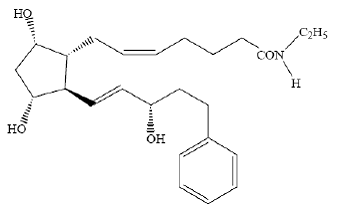
Bimatoprost is een poeder dat zeer goed oplosbaar is in ethylalcohol en methylalcohol en slecht oplosbaar is in water. LUMIGAN® 0,03% is een heldere, isotone, kleurloze, steriele oftalmische oplossing met een osmolaliteit van ongeveer 290 mOsmol/kg.
LUMIGAN® 0,03% bevat Actief: bimatoprost 0,3 mg/ml; Inactieven: benzalkoniumchloride 0,05 mg/ml; natriumchloride; natriumfosfaat, dibasisch; citroenzuur; en gezuiverd water. Natriumhydroxide en/of zoutzuur kunnen worden toegevoegd om de pH aan te passen. De pH tijdens de houdbaarheid varieert van 6,8-7,8.
INDICATIES
LUMIGAN® (bimatoprost oftalmische oplossing) 0, 01% is geïndiceerd voor de verlaging van verhoogde intraoculaire druk bij patiënten met openhoekglaucoom of oculaire hypertensie.
DOSERING EN ADMINISTRATIE
De aanbevolen dosering is eenmaal daags 's avonds één druppel in het (de) aangedane oog (ogen). LUMIGAN® (bimatoprost oftalmische oplossing) 0, 01% mag niet vaker dan eenmaal per dag worden toegediend, omdat is aangetoond dat frequentere toediening van prostaglandine-analogen het intraoculaire drukverlagende effect kan verminderen.
De verlaging van de intraoculaire druk begint ongeveer 4 uur na de eerste toediening en het maximale effect wordt bereikt binnen ongeveer 8 tot 12 uur.
LUMIGAN® 0, 01% kan gelijktijdig worden gebruikt met andere lokale oogheelkundige geneesmiddelen om de intraoculaire druk te verlagen. Als er meer dan één actueel oogheelkundig geneesmiddel wordt gebruikt, moeten de geneesmiddelen met een tussenpoos van ten minste vijf (5) minuten worden toegediend.
HOE GELEVERD
Doseringsvormen en sterke punten
Oftalmische oplossing die bimatoprost 0,1 mg/ml bevat.
Opslag en overhandiging
LUMIGAN® (bimatoprost oogheelkundige oplossing) 0, 01% wordt steriel geleverd in ondoorzichtige witte lage dichtheid polyethyleen oogheelkundige dispenserflessen en tips met turquoise polystyreen doppen in de volgende maten:
2,5 ml vul een 5 ml container - NDC 0023-3205-03 5 ml vul een 10 ml container - NDC 0023-3205-05 7,5 ml vul een 10 ml container - NDC 0023-3205-08
Opslag: Bewaren bij 2 ° C tot 25 ° C (36 ° F tot 77 ° F).
Na opening kan LUMIGAN® 0,01% worden gebruikt tot de vervaldatum op de fles.
Gedistribueerd door: Allergan USA, Inc. Madison, NJ 07940. Herzien: maart 2022
BIJWERKINGEN
De volgende bijwerkingen worden elders in de etikettering beschreven:
- Pigmentatie inclusief ooglidpigmentatie en irishyperpigmentatie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Wimperveranderingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Intraoculaire ontsteking [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Macula-oedeem [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- overgevoeligheid [zie CONTRA-INDICATIES ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
In een 12 maanden durend klinisch onderzoek met bimatoprost oogheelkundige oplossingen 0,01% was de meest voorkomende bijwerking conjunctivale hyperemie (31%). Ongeveer 1,6% van de patiënten stopte met de behandeling vanwege conjunctivale hyperemie. Andere bijwerkingen (gemeld bij 1 tot 4% van de patiënten) met LUMIGAN® 0,01% in deze studie omvatte conjunctivaal oedeem, conjunctivale bloeding, oogirritatie, oogpijn, oogpruritus, erytheem van het ooglid, ooglidpruritus, groei van wimpers, hypertrichose, irritatie van de instillatieplaats, puntvormige keratitis, hyperpigmentatie van de huid, wazig zien en gezichtsscherpte verminderd.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van: LUMIGAN® 0,01%. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen. Deze reacties, die voor opname zijn gekozen vanwege hun ernst, frequentie van melding of mogelijk causaal verband met: LUMIGAN® , of een combinatie van deze factoren omvatten: astma-achtige symptomen, duizeligheid, droge ogen, kortademigheid, oogafscheiding, oogoedeem, gevoel van vreemd lichaam, hoofdpijn, overgevoeligheid inclusief tekenen en symptomen van oogallergie en allergische dermatitis, hypertensie, verhoogde tranenvloed, periorbitale en ooglidveranderingen, waaronder verdieping van de ooglidsulcus en fotofobie.
DRUG-INTERACTIES
Geen informatie verstrekt
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
pigmentatie
Van Bimatoprost oftalmische oplossing is gemeld dat het veranderingen in gepigmenteerde weefsels veroorzaakt. De meest frequent gemelde veranderingen zijn toegenomen pigmentatie van de iris, periorbitaal weefsel (ooglid) en wimpers. De pigmentatie zal naar verwachting toenemen zolang bimatoprost wordt toegediend. De pigmentatieverandering is eerder te wijten aan een verhoogd melaninegehalte in de melanocyten dan aan een toename van het aantal melanocyten. Na stopzetting van de behandeling met bimatoprost is de pigmentatie van de iris waarschijnlijk permanent, terwijl is gemeld dat pigmentatie van het periorbitale weefsel en wimperveranderingen bij sommige patiënten reversibel zijn. Patiënten die worden behandeld, moeten worden geïnformeerd over de mogelijkheid van verhoogde pigmentatie. De langetermijneffecten van verhoogde pigmentatie zijn niet bekend.
Iriskleurverandering kan enkele maanden tot jaren niet merkbaar zijn. Doorgaans verspreidt de bruine pigmentatie rond de pupil zich concentrisch naar de periferie van de iris en wordt de hele iris of delen van de iris bruinachtiger. Noch naevi, noch sproeten van de iris lijken te worden beïnvloed door de behandeling. Hoewel de behandeling met LUMIGAN® (bimatoprost oftalmische oplossing) 0, 01% kan worden voortgezet bij patiënten die een merkbaar verhoogde irispigmentatie ontwikkelen, moeten deze patiënten regelmatig worden onderzocht.
Wimperveranderingen
LUMIGAN® 0,01% kan de wimpers en vellushaar in het behandelde oog geleidelijk veranderen. Deze veranderingen omvatten een grotere lengte, dikte en aantal wimpers. Wimperveranderingen zijn meestal omkeerbaar na stopzetting van de behandeling.
Intraoculaire ontsteking
Van prostaglandine-analogen, waaronder bimatoprost, is gemeld dat ze intraoculaire ontsteking veroorzaken. Omdat deze producten ontstekingen kunnen verergeren, is bovendien voorzichtigheid geboden bij patiënten met actieve intraoculaire ontsteking (bijv. uveïtis).
Macula-oedeem
Macula-oedeem, inclusief cystoïd macula-oedeem, is gemeld tijdens behandeling met bimatoprost oftalmische oplossing. LUMIGAN® 0,01% moet met voorzichtigheid worden gebruikt bij afake patiënten, bij pseudofake patiënten met een gescheurd achterste lenskapsel of bij patiënten met bekende risicofactoren voor macula-oedeem.
Bacteriële keratitis
Er zijn meldingen geweest van bacteriële keratitis in verband met het gebruik van flacons met meerdere doses actuele oftalmische producten. Deze containers waren per ongeluk besmet door patiënten die, in de meeste gevallen, een gelijktijdige cornea-aandoening of een verstoring van het oogepitheeloppervlak hadden.
Gebruik van contactlenzen
LUMIGAN® 0,01% bevat benzalkoniumchloride, dat kan worden geabsorbeerd door en verkleuring van zachte contactlenzen kan veroorzaken. Contactlenzen moeten worden verwijderd voordat LUMIGAN® 0,01% wordt ingebracht en kunnen 15 minuten na toediening opnieuw worden ingebracht.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Bimatoprost was niet carcinogeen bij muizen of ratten bij orale toediening gedurende 104 weken in doses tot respectievelijk 2 mg/kg/dag en 1 mg/kg/dag (192 en 291 maal de geschatte humane systemische blootstelling aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd, gebaseerd op de AUC-waarden in het bloed)
Mutagenese
Bimatoprost was niet mutageen of clastogeen in de Ames-test, in de muislymfoomtest of in de in vivo micronucleustests bij muizen.
Aantasting van de vruchtbaarheid
Bimatoprost had geen invloed op de vruchtbaarheid bij mannelijke of vrouwelijke ratten tot doses van 0,6 mg/kg/dag (ten minste 103 keer de aanbevolen menselijke blootstelling aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd op basis van de AUC-waarden in het bloed).
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Er zijn geen adequate en goed gecontroleerde onderzoeken naar toediening van LUMIGAN® (bimatoprost oftalmische oplossing) 0, 01% bij zwangere vrouwen. Er is geen verhoogd risico op ernstige geboorteafwijkingen of miskramen op basis van postmarketingervaring met bimatoprost.
In embryofoetale ontwikkelingsstudies resulteerde toediening van bimatoprost aan zwangere muizen en ratten tijdens organogenese in abortus en vroege bevalling bij orale doses van ten minste 33 keer (muizen) of 94 keer (ratten) de menselijke blootstelling aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd ( op basis van bloedoppervlakte onder de curve [AUC]-waarden). Deze bijwerkingen werden niet waargenomen bij 2,6 maal (muizen) en 47 maal (ratten) de menselijke blootstelling aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd (op basis van bloed-AUC-spiegels).
In pre-/postnatale ontwikkelingsstudies resulteerde toediening van bimatoprost aan drachtige ratten vanaf de organogenese tot het einde van de lactatie in een kortere drachtduur en foetaal lichaamsgewicht, en verhoogde foetale en jongensterfte bij orale doses van ten minste 41 maal de humane systemische blootstelling aan bimatoprost 0,03 % eenmaal daags bilateraal gedoseerd (op basis van bloed-AUC-spiegels). Er werden geen bijwerkingen waargenomen bij nakomelingen van ratten bij blootstellingen die werden geschat op 14 keer de menselijke blootstelling aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd (op basis van bloed-AUC-waarden).
Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons bij de mens, mag LUMIGAN® 0,01% alleen tijdens de zwangerschap worden toegediend als het mogelijke voordeel het mogelijke risico voor de foetus rechtvaardigt.
Gegevens
Dierlijke gegevens
In een embryofoetale ontwikkelingsstudie bij ratten werd abortus waargenomen bij zwangere ratten die bimatoprost oraal kregen toegediend tijdens de organogenese van 0,6 mg/kg/dag (94 keer de systemische blootstelling bij de mens aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd, gebaseerd op de AUC). De No Observed Adverse Effect Level (NOAEL) voor abortus was 0,3 mg/kg/dag (geschat op 47 maal de systemische blootstelling bij de mens aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd, gebaseerd op de AUC). Er werden geen afwijkingen waargenomen bij rattenfoetussen bij doses tot 0,6 mg/kg/dag.
In een embryofoetale ontwikkelingsmuisstudie werden abortus en vroege bevalling waargenomen bij zwangere muizen die bimatoprost oraal kregen toegediend tijdens de organogenese in doses hoger dan of gelijk aan 0,3 mg/kg/dag (33 maal de humane systemische blootstelling aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd, op basis van AUC). De NOAEL voor abortus en vroege bevalling was 0,1 mg/kg/dag (2,6 maal de humane systemische blootstelling aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd, gebaseerd op de AUC). Er werden geen afwijkingen waargenomen bij muizenfoetussen bij doses tot 0,6 mg/kg/dag (72 keer de humane systemische blootstelling aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd, gebaseerd op de AUC).
In een pre-/postnataal ontwikkelingsonderzoek resulteerde de orale behandeling van drachtige ratten met bimatoprost van dag 7 van de dracht tot dag 20 van de lactatie in een kortere drachtduur, verhoogde late resorptie, foetale sterfte en postnatale sterfte van de jongen, en een verminderd lichaamsgewicht van de jongen bij doses hoger dan of gelijk aan 0,3 mg/kg/dag. Deze effecten werden waargenomen bij blootstellingen van ten minste 41 maal de systemische blootstelling bij mensen aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd, gebaseerd op de AUC. De NOAEL voor postnatale ontwikkeling en paringsprestaties van de nakomelingen was 0,1 mg/kg/dag (geschat op 14 keer de systemische blootstelling bij mensen aan bimatoprost 0,03% eenmaal daags bilateraal gedoseerd, gebaseerd op AUC).
Borstvoeding
Risico Samenvatting
Het is niet bekend of lokale oculaire behandeling met LUMIGAN® 0,01% zou kunnen resulteren in voldoende systemische absorptie om aantoonbare hoeveelheden in de moedermelk te produceren. In dierstudies is aangetoond dat bimatoprost aanwezig is in de moedermelk van zogende ratten bij een intraveneuze dosis (dwz 1 mg/kg) 970 maal de RHOD (op basis van mg/rn2), maar er zijn geen diergegevens beschikbaar in klinisch relevante doses.
Er moet rekening worden gehouden met de ontwikkelings- en gezondheidsvoordelen van borstvoeding, samen met de klinische behoefte van de moeder aan LUMIGAN® 0,01% en eventuele nadelige effecten op het kind dat borstvoeding krijgt van LUMIGAN® 0,01%.
Pediatrisch gebruik
Gebruik bij pediatrische patiënten jonger dan 16 jaar wordt niet aanbevolen vanwege mogelijke veiligheidsproblemen in verband met verhoogde pigmentatie na langdurig chronisch gebruik.
Geriatrisch gebruik
Er zijn geen algemene klinische verschillen in veiligheid of werkzaamheid waargenomen tussen oudere en andere volwassen patiënten.
OVERDOSERING
Er is geen informatie beschikbaar over overdosering bij mensen. Als een overdosering met LUMIGAN® (bimatoprost oftalmische oplossing) 0, 01% optreedt, moet de behandeling symptomatisch zijn.
In orale (via een maagsonde) onderzoeken met muizen en ratten veroorzaakten doses tot 100 mg/kg/dag geen toxiciteit. Deze dosis uitgedrukt in mg/m2 is minstens 210 keer hoger dan de accidentele dosis van één fles LUMIGAN® 0,01% voor een kind van 10 kg.
CONTRA-INDICATIES
LUMIGAN® 0,01% is gecontra-indiceerd bij patiënten met overgevoeligheid voor bimatoprost of voor een van de bestanddelen [zie ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Bimatoprost, een prostaglandine-analoog, is een synthetisch structureel analoog van prostaglandine met oculaire hypotensieve activiteit. Het bootst selectief de effecten na van natuurlijk voorkomende stoffen, prostamiden. Er wordt aangenomen dat bimatoprost de intraoculaire druk (IOP) bij mensen verlaagt door de uitstroom van kamerwater via zowel het trabeculaire netwerk als de uveosclerale routes te vergroten. Verhoogde IOD vormt een belangrijke risicofactor voor glaucoomveldverlies. Hoe hoger het IOP-niveau, hoe groter de kans op beschadiging van de oogzenuw en verlies van gezichtsveld.
Farmacokinetiek
Absorptie
Nadat gedurende twee weken één druppel bimatoprost oftalmische oplossing 0,03% eenmaal daags aan beide ogen van 15 gezonde proefpersonen was toegediend, bereikten de bloedconcentraties binnen 10 minuten na toediening een piek en waren bij de meeste proefpersonen binnen de 1,5 uur na dosering. De gemiddelde Cmax- en AUC0-24hr-waarden waren vergelijkbaar op dag 7 en 14 bij respectievelijk ongeveer 0,08 ng/ml en 0,09 ng•hr/ml, wat aangeeft dat steady-state werd bereikt tijdens de eerste week van oculaire dosering. Er was geen significante systemische geneesmiddelaccumulatie in de tijd.
Verdeling
Bimatoprost wordt matig verdeeld in lichaamsweefsels met een steady-state distributievolume van 0,67 l/kg. In menselijk bloed bevindt bimatoprost zich voornamelijk in het plasma. Ongeveer 12% van bimatoprost blijft ongebonden in humaan plasma.
Eliminatie
Metabolisme
Bimatoprost is de belangrijkste circulerende stof in het bloed zodra het de systemische circulatie bereikt na oculaire dosering. Bimatoprost ondergaat vervolgens oxidatie, N-deethylering en glucuronidering om een grote verscheidenheid aan metabolieten te vormen.
uitscheiding
Na een intraveneuze dosis radioactief gelabelde bimatoprost (3,12 mcg/kg) aan zes gezonde proefpersonen, was de maximale bloedconcentratie van onveranderd geneesmiddel 12,2 ng/ml en nam deze snel af met een eliminatiehalfwaardetijd van ongeveer 45 minuten. De totale bloedklaring van bimatoprost was 1,5 l/uur/kg. Tot 67% van de toegediende dosis werd uitgescheiden in de urine, terwijl 25% van de dosis werd teruggevonden in de feces.
Klinische studies
In een 12 maanden durend klinisch onderzoek bij patiënten met openhoekglaucoom of oculaire hypertensie met een gemiddelde IOD bij baseline van 23,5 mmHg, was het IOD-verlagende effect van LUMIGAN® 0,01% eenmaal daags ('s avonds) tot 7,5 mmHg.
PATIËNT INFORMATIE
Potentieel voor pigmentatie
Adviseer patiënten over de mogelijkheid van verhoogde bruine pigmentatie van de iris, die permanent kan zijn. Informeer patiënten ook over de mogelijkheid van verdonkering van de ooglidhuid, die omkeerbaar kan zijn na stopzetting van LUMIGAN® (bimatoprost oftalmische oplossing) 0, 01%.
Potentieel voor wimperveranderingen
Informeer patiënten over de mogelijkheid van wimper- en vellushaarveranderingen in het behandelde oog tijdens de behandeling met LUMIGAN® 0,01%. Deze veranderingen kunnen resulteren in een verschil tussen de ogen in lengte, dikte, pigmentatie, aantal wimpers of vellusharen en/of richting van wimpergroei. Wimperveranderingen zijn meestal omkeerbaar na stopzetting van de behandeling.
Omgaan met de container
Instrueer patiënten om te voorkomen dat de punt van de dispenser in contact komt met het oog, de omliggende structuren, vingers of een ander oppervlak om contaminatie van de oplossing door gewone bacteriën waarvan bekend is dat ze ooginfecties veroorzaken, te voorkomen. Ernstige schade aan het oog en daaropvolgend verlies van gezichtsvermogen kan het gevolg zijn van het gebruik van verontreinigde oplossingen.
Wanneer moet u een arts raadplegen?
Adviseer patiënten dat als ze een bijkomende oogaandoening ontwikkelen (bijv. trauma of infectie), een oogoperatie ondergaan of oogreacties ontwikkelen, met name conjunctivitis en ooglidreacties, ze onmiddellijk het advies van hun arts moeten inwinnen over het voortgezette gebruik van LUMIGAN® 0,01% .
Gebruik van contactlenzen
Adviseer patiënten dat LUMIGAN® 0,01% benzalkoniumchloride bevat, dat kan worden geabsorbeerd door zachte contactlenzen. Contactlenzen moeten worden verwijderd voordat LUMIGAN® 0,01% wordt ingebracht en kunnen 15 minuten na toediening opnieuw worden ingebracht.
Gebruik met andere oogheelkundige geneesmiddelen
Adviseer patiënten dat als er meer dan één actueel oftalmisch geneesmiddel wordt gebruikt, de geneesmiddelen ten minste vijf (5) minuten tussen de toepassingen moeten worden toegediend.
